どのようにdアラビノースを生産しますか?
D Arabinitol is an important natural product that is widely found in lichen plants とsome food-derived fungi. However, its natural content is low, とit requires a large amount のraw materials in traditional processes, which seriously affects its economic benefits とmakes it unsuitable for large-scale production [1,2]. The chemical catalytic method uses nickel as a catalyst to undergo redox reactions, reducing arabinose to generate D-arabinitol. This is currently the most mainstream method for the industrial production のD-arabinitol [3]. Although the chemical catalytic method can achieve industrial scale in the marketand the production technology is relatively mature, the production 過程requires the use のexpensive catalysts and strict control のconditions such as high temperature (100°C) and high pressure (40-60 bar) [4]. This not only pollutes the environment but also makes it difficult to separate and purify the subsequent products, resulting in high production costs [5].
d-アラビニトールの生物学的生産に必要な生産条件は、化学触媒法に比べて穏やかである。物质の変換は、微生物による成長と代謝が成し遂げたもので得られる製品を分離し易く、、、収量性の純度D-arabinitolを向上させることができる(図6、図7)という線」という考えが青いの経済的環境にやさしい。主な生物学的手法として、微生物発酵と静止細胞の形質転換の2つがある。微生物発酵法では、主にグリセロール、キシロース、ラクトース、グルコース、キシリトールなどの基質を微生物の成長や代謝過程で変換することによってd-アラビニトールが生成されます[8,9]。静止細胞変換法は、主に培養した細菌液を濃縮して静止細胞を調製し、静止細胞に存在する様々な酵素を利用してd-アラビニトールを変換する。
以上のように、d-アラビニトールの製造方法にはそれぞれ特徴があるが、生物学的方法は、微生物の正常な成長と代謝によって物質の変換を実現するため、グリーンで経済的で環境に優しいという利点がある。また、生物学的方法の生成物は分離と精製が容易で、d-アラビニトールの純度と収率を向上させる。化学触媒法は依然として主要な生産方法であるが、生物学的方法はより有望な代替手段となっている。
1. d-アラビトールの生物学的生産の現在の研究状況
高浸透圧耐性酵母は、d-アラビトールを生産することができる自然界の主要な微生物である。高い浸透圧下では、酵母細胞は脱水ストレスに対処するためにポリオールを合成・蓄積し、細胞を損傷から守ることができる。1956年、spencerらは、高浸透圧耐性酵母がグルコースの発酵によってd-アラビトールを含む様々なポリオールを生産できることを発見した[10]。大西らは1969年、グルコースが微生物の作用でキシリトールに変換され、d-アラビニトールが中間生成物であることを発見した[11,12]。この発見はキシリトールの生物学的生産の理論的基礎を築き、国内外の研究者の注目を集めた。
At present, research on the production のD-arabinitol mainly focuses on strain screening and fermentation condition optimization. For example, Song Weibin et アルscreened a strain of Saccharomyces cerevisiae that produces D-arabinitol からpollen, and improved the conversion rate after optimizing the fermentation conditions [12]. Li Ze et al. isolated a strain of Pichia pastoris L-84 from soil microorganisms that is resistant to high osmotic pressure and produces D-arabinitol, and carried out large-scale fermentation in a fermenter [13]. Saha et al. used a strain of Rhodotorula glutinis NRRLY-27624 obtained by screening from a wild honeycomb to optimize the fermentation conditions and finally achieve the fermentation of glucose to produce D-arabinitol, with a conversion rate of 48% [14][15].
zhang liliは、debaryomyces hanseniiからd-アラビトールの高収量株を単離することに成功し、d-アラビトール発酵の速度論モデルを確立した[16]。野崎氏は、d-アラビトールを効率的に生産するrhodotorula kofmei aj14787株をスクリーニングした。温度可変栽培と700 g/ lの連続供給を組み合わせて発酵最適化を行い、最終的に206 g/ lの発酵でd-アラビトールを生産した[17]。chengらはピヒア・パストリス系統に適応進化を適用し、野生型と比較して収量が72.7%増加した[18]。
m povelainenらは、変換効率が最大38%で、応用の見込みが良いd-アラビトールを産生する遺伝子組み換え細菌bacillus subtilis atcc31094を構築した[19]。その後の研究で、candida属[20]、kluyveromyces属[21]、kodamea属[22,23]、hansenula属[24,25]、debaryomyces属[26]がd-アラビトールを産生することができることが判明しました[27]。
2. d-アラビニトールのバイオ生産のための代謝経路
現在の研究ではグルコースのような基質がキシロース[28]、グリセロール[29、30]およびラクトース[31]をd-アラビニトールの生産に使用することができる。グルコースとキシロースは、自然界の炭素源埋蔵量の上位2位に位置しており、最も費用対効果の高い基質と広く考えられています。従来の研究では、グルコースからd-アラビトールを生産する代謝経路は主に2つの合成経路があるが、キシロースからd-アラビトールを生産する代謝経路はキシリトールしかないとされている。d-アラビトールの3つの一般的な代謝経路を図1.2に示す。
図1ダルビトールの代謝経路
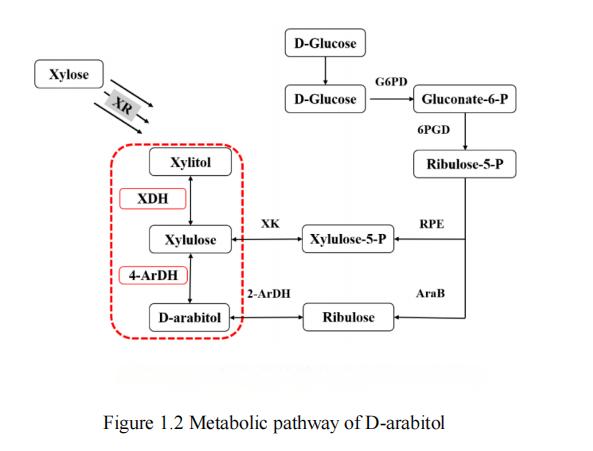
グルコースからダラビトールを生産する代謝過程には、リブロース経路とキシルロース経路の2つの合成経路が存在する。これらの過程で、グルコースは最初にグルコース-6-リン酸にリン酸化され、次にペントースリン酸経路(ppp経路)を介して5-リン酸- d-リブロースに変換される。5-リンホ- d-リボースがリブロースキナーゼによってd-リブロースに変換され、2- ardhによってd-アラビニトールに変換されると、リブロース経路が形成される。別の代謝経路では、5-リン酸- d-リボースはd-キシルロース-5-リン酸に異性化され、その後d-キシルロースに脱リン酸化される。次に、d-アラビトール- 4-デヒドロゲナーゼが変換するxyluloseにD-arabitolその結果、キシルロース経路が形成される[32]。
キシロースからd-アラビトールを生産するための代謝経路は、主にキシリトール経路という合成経路である。この過程で、キシロースレダクターゼはまずキシロースをキシリトールに変換する。その後、キシリトールデヒドロゲナーゼ(xdh)はキシリトールをd-キシルロースに還元する。最後に、d-アラビトールデヒドロゲナーゼ(ardh)がd-キシルロースをd-アラビトールに変換し、キシリトール経路の合成が完了する。
要約すると、グルコースとキシロースは生体内代謝工学における2つの一般的で安価な基質として、ペントースリン酸経路、キシルロース経路、キシリトール経路などの様々な経路を介してd-アラビニトールを生成するために使用することができる。これらの代謝経路は、研究者に豊富な生合成戦略を提供し、実用的な機能性糖アルコールのニーズを満たすためにd-アラビニトールの生産プロセスをさらに探索し、最適化するのに役立ちます。
3. 微生物発酵によるd-アラビニトールの生産に影響を与える要因
発酵の過程で、d-アラビニトールの収量は様々な要因によって制限される。現在、ph、温度、炭素と窒素源の組成、接種体のサイズ、回転速度、溶存酸素濃度などの発酵条件を最適化することにより、d-アラビニトールの収量を効果的に増加させることができます[33,34]。これらの因子は、生産宿主の代謝過程に密接に関連している。これらのパラメータを調整することで、理想的な発酵条件を確立し、発酵収量を増加させることができます。
現在、d-アラビニトールの生物学的生産のほとんどの研究は、グルコースからd-アラビニトールの発酵に焦点を当てており、キシロースからd-アラビニトールの生産の研究はあまりありません。グルコースの成長過程で多くの酵母がd-アラビニトールを産生することが知られているが、キシロースからd-アラビニトールを産生する酵母はほとんど知られていない。jagtapら[28]は、rhodosporidium toruloides ifo0880が窒素豊富な培地中のキシロースからd-アラビニトールを生成することを2018年に初めて報告した。これは、天然酵母が唯一の炭素源としてキシロースを利用してd-アラビニトールを生産できることを初めて発見したことであり、d-アラビニトールの生物学的生産の代謝過程にキシリトール経路が存在することが確認された。この過程で、キシロースは最初にキシロースレダクターゼによってキシリトールに変換される。その後、キシリトールはxdhによってd-キシルロースに還元される。最後に、ardhはd-キシルロースをd-アラビニトールに変換する。

初期基質濃度を高くすると発酵菌株に浸透圧がかかり、順方向のバイオ変換反応が促進され、d-アラビトールの収量が増加する。例えば、debaryomyces hansenii sbp-1の発酵中、150 g/ lのキシロースを使用すると、70 g/ lのキシロースを使用する場合と比較して、d-アラビトールの収量が2.23倍増加する。debaryomyces hansenii nrrly-7483を使用した発酵では、1.5%のグリセロールを使用すると、0.5%のグリセロールと比較して、d-アラビトールの生産量が4 ~ 5倍増加する[35]。カンジダsp. h2の成長および代謝中[36]、d-アラビニトールの生産量はグルコース濃度の上昇に伴って有意に増加し、250 g/ lグルコースが最適な初期糖濃度であった。しかし、基質濃度が高すぎるとd-アラビトール合成に悪影響を及ぼす可能性がある。例えばzygosaccharomyces rouxii jm-c46の栽培では、グルコース濃度を200 g/ lから250 g/ lに上げてもd-アラビトールの生産量はそれ以上増加しなかった。
Nitrogen sources are key elements in microbial fermentation systems and are closely related to the regulation of microbial growth and metabolism. For example, the optimal nitrogen source for Candidasp. H2[37] and Candida quercitrusa is yeast extract, while ammonium sulfate is the optimal nitrogen source for Pichia Manchurica[38] and Debaryomyces Hansenii. Kumdam[39] and Loman[40] found that adding an appropriate amount of nitrogen source to the medium can increase the production of D-arabitol. Similarly, Jagtap et al. found that Rhodosporidium toruloides IFO0880 can convert xylose to produce high titers of D-arabitolin nitrogen-rich media. The yield of D-arabitol increased with the increase of nitrogen content in the medium. However, high nitrogen concentrations may be detrimental to the production of D-arabitol by Kluyveromyces ohmeri strains [41].
微生物の発酵過程で、適切な量の金属イオンを添加することで、細胞内液の浸透圧バランスを維持し、細胞内酵素の活性を高め、微生物の成長と代謝を促進する。吉川はcandida quercitrusaによる金属イオンのd-アラビニトール産生への影響を調べ、カルシウムイオンがd-アラビニトール産生を促進することを発見した。その理由は、カルシウムイオンが細胞内に浸透し、細胞の成長と代謝経路の酵素の活性を高めるからです。kumdam[42]とsundaramoorthyの別の研究では、亜鉛、鉄、マンガン、銅イオンがdebaryomyces nepalensisおよびpichia manchurica株の成長代謝を促進し、d-アラビニトールの生産を増加させることが明らかになった。
3.1キシリトールデヒドロゲナーゼ
キシリトールデヒドロゲナーゼは、d-アラビニトール生産の生合成経路における重要な速度制限酵素である。xdhは、微生物によるキシロースの代謝において重要な役割を果たし、d-アラビニトールを産生する。可逆的な酸化還元酵素として、xdhの触媒活性は補因子nad +とnadhに依存する[43,44]。
This enzyme is mainly found in yeasts that ferment xylose to produce xylitolpaecilomyces taphios、candida shehatae、pichiastipitisなど[45]。fusarium oxysporumやneurospora crassaのような糸状菌もxdhの重要な供給源である。これらの異なる種のxdhsの活性中心配列が高度に保存されていることは注目に値する[46]。
正一らは[47]gluconobacter oxycans atcc621からxdh遺伝子をクローンし、zhangらは[48]gluconobacter oxycans nh-10でxdh遺伝子を研究し、qiらは[49]gluconobacter oxycans cgm cc 1.49からxdh遺伝子をクローンした。
本研究では、異なる系統からxdh遺伝子をクローニングし、大腸菌bl21で発現させることに成功しました。彼らはまた、xdhの酵素的性質を調べ、異なるソースから得られたこれらのxdhの酵素的性質がある程度似通っていることを見いだした。他の研究では、xdhは短鎖デヒドロゲナーゼに属することが分かっている。nad +を補酵素とするキシリトール酸化反応では、xdhの最適phは11である。nadhを補酵素とするd-キシルロース還元反応では、xdhの最適phは5である。したがって、酸化反応におけるxdhの最適なphはアルカリ性であり、還元反応における最適なphは酸性であると推測できます。
つまり、xdhは生物学的に重要である。xdhの酵素的性質は系統によって異なるが、タンパク質の配列や酵素的性質の点である程度の類似性を共有している。現在の研究では、xdhは異なる反応条件で異なる最適ph値を持つことが示されており、この酵素のさらなる研究と応用の基礎となっている。
4分子修正
xdhは多様な触媒特性を持ち、生体触媒において重要な役割を果たしている。しかし、天然の酵素は活性、基質スペクトル、触媒特異性などに限界があり、理想的な収率を達成することは困難です。近年、タンパク質工学の手法として、方向進化、合理的設計、半合理的設計が酵素修飾に広く用いられている。これらの戦略は、酵素の性能を効果的に向上させ、実際の生産ニーズをよりよく満たすことができる。
進化分子工学5
フランセス・アーノルドが1993年に方向進化の概念を最初に提唱して以来、この分野は近年目覚ましい進歩を遂げている[50]。酵素工学で重要な役割を果たすdirected evolutionの基本的な考え方は、自然の進化過程をシミュレートし、人工的なランダム変異を導入し、高性能変異体を選別することである。
また、酵素の構造、機能、触媒機構についての深い理解がなくても、酵素の機能を効果的に変えることができるという利点もある。指向的進化戦略の主なステップは、変異体の構築と変異ライブラリーのスクリーニングである。このプロセスでは、エラーを起こしやすいpcrやdnaシャッフル[51]などのランダムな突然変異や遺伝子組換え技術が使用されます。
これらの技術の応用は、変異体構築の効率と変異体ライブラリーの多様性を大幅に向上させた。しかし、指向性進化戦略の実施は、特にハイスループットスクリーニングの段階でいくつかの課題に直面している[52]。優れた変異体を迅速に特定して選択する方法として、ハイスループットスクリーニングは指向性進化プロセスに不可欠である[53]。
特定の変異ライブラリに対するハイスループットなスクリーニング法は、対象とする製品に応じて特別に設計する必要があるため、普遍的なスクリーニング法はありません。この段階でのスクリーニングプロセスの特定の設計と課題は、方向性のある進化戦略の複雑さを確実に増大させる。全体として、ハイスループットスクリーニング法の特定の設計と課題にもかかわらず、向進化技術は依然として酵素の分子工学のための有効なツールであると考えられている。その大きな貢献と継続的な発展傾向は、この分野がバイオテクノロジーおよび関連分野において重要な役割を果たし続けることを示しています。
参考:
[1]エスカランテ J Caminal G Figueredo M et al. 生産 of arabitol from hansenula polymorpha[j]によるgl ucose。 誌 発酵 and Bioenginee指輪 1990年70人(4):228-231。
[2] moran j w, witter l d . saccharomyces rouxiiにおける糖オンダラビトール産生およびグルコース代謝の影響[j]。1979年日刊細菌学、138(3):823 -天長8年)。
[3] murthy s n, kumdam h, gummadi sn。微生物fermenによるアラビトール生産- tation-生合成 と将来のアプリケーションか[J]な数字について話しましょうinternational journal of sciences basic &^『読売新聞』2014年1月1日、1-12頁。
[4] kumdam h、narayana m s、gummadi s n . debaryomycesによるエタノールとアラビトールの生産 nepalensis: 影響 of 過程 パラメータ[J]。 AMB 2013年急行、3 (1):23 .
[5] zhang g, liny, he p, et al。糖アルコール生産の特徴酵母pichia anomala [J]。 誌 of 産業 微生物学 & バイオテクノロジーや、2014年、41(1)系統41-48人である。
[6] huang wei, wang xiaodan, li dounan, et al。d-アラビトールの微生物発酵に関する研究[j]。中国醸造,2017,36(09):6-10。
[7] ding xiaobing, li zongwei, yang zhuanqin, et al。酵素生成液中のイソロイシン含有量を測定するための紙クロマトグラフィーの改良[j]。食品産業科学技術,2009,30(08):314-315。
[8] akinosho h, rydzak t, borole a, et al。微生物バイオエタノール生産に対する毒性学的課題と耐性向上のための戦略[j]。2015年Ecotoxicology、24日(10日):" 2156-2174。
[9] qian weidong, ning xiaoxiao, wang lan, et al。高収量d-アラビニトール酵母の迅速スクリーニング法[j]。陝西科学技術大学誌,2014(6):129-133。
[10] spencer j f t, sallans h r . osmophilic yeasts by polyhydric alcohols production of polyhydric alcohol by osmophilic yeasts [j]。^「canadian journal of microbiology」(英語). canadian journal of microbiology (1956) . pp . 72-79. 2010年3月25日閲覧。
[11] onishi h, suzuki t .グルコースからのキシリトールの生産[j]。1970年(昭和45年)、「応用微生物学、18(6):1031-1035。
[12] song weibin, lin yanqing, hu haiyan, et al。d-アラビトール生産株のスクリーニングと同定およびd-アラビトール生産条件の最適化[j]。 ^『仙台市史』通史編1(仙台市史)、339 -339頁。
【13】李沢、趙相英、劉建軍。d-アラビノール産生酵母のスクリーニングと同定[j]。2012年(平成24年)10月27日-30日。
[14] guo q, zabedh, zhang h, et al。新規分離酵母(zygosaccharomyces rouxii jm-c46)の発酵培地の最適化と生合成に影響する因子の評価[j]。食物&科学;技術、019 99:319 - 327。
[15] saha b c、sakakibaray、cotta m a .新たに単離されたzygosaccharomyces rouxiiによるdarabitolの生産[j]。journal of industrial microbiology and biotechnol - ogy, 2007,34(7):519-523。
[16]張麗麗と。高収量d-アラビニトール酵母株のスクリーニングと発酵条件の検討[d]。江南大学、2009年。
[17] nozaki h, suzuki s, tsuyoshi n, et al。メッチュニコウィア・レウカウフィー(metschnikowia reukaufii)によって製造された AJ14787 [J]。 ウルリッヒ?、 バイオテクノロジー and 2003年生化学67(9):グレイス・クーリッジは。
[18] cheng h, lv j, wang h, et al。単発酵法によるグルコースからキシリトールへの変換のための遺伝子組み換えピシアパストリス酵母[j]。応用mi - crobiology and biotechnology, 2014,98(8):3539-3552。
[19] zheng s, jiang b, zhang t, et al。カンジダ・パラプシローシスからのエンハンセダラビトール産生への変異誘発と代謝調節を組み合わせた[j]。journal of indus—trial microbiology &バイオテクノロジー47 2020年、(4):425-435。
[20] wang l, hui m, yin y, et al。高収率d-arabitol株の単離とスクリーニング[j]。食品安全・品質検査学会誌,2014,5(12):4018-4025。
[21] toyoda t, ohtaguchi k . kluyveromyces lactisによるラクトースからのダラビトール産生に対する温度の影響[j]。2011年誌『産業微生物とバイオテクノロジー、38(9):1179-1185。
[22] cai li, zhang yang, zhu hongyang, et al。d-アラビトール産生株の単離、スクリーニングおよび同定[j]。2009年発酵业、35(01年):26。
[23] saha b c, cotta s m a .新たに単離されたzygosaccharomycesによるd -アラビトールの生産 zygosaccharomycesrouxii [J]。 誌 of 産業 微生物学 & 2007年バイオテクノロジー34(7):519-523。
[24] qian weidong, ning xiaoxiao, zhao dezhi, et al。hansenula多型の発酵を改良し、組み合わせ戦略を用いてd-アラビトールを生産する[j]。安徽農業科学,2014,42(23):7726-7728。
【25】王剛、唐暁芳、張国東。hansenula anomalaによるグルコースからアラビトールへの変換に関する研究[j]。^『仙台市史』(仙台市、2012年)317 -317頁。
[26] zhang lili, liao defang, ding chongyang, et al。hansenula polymorphaによるグルコースの発酵からd-アラビトールが生成する[j]。^産業微生物学、2010年、40(04):47-52。
【27】斗元。ピヒア・パストリスの代謝工学とd-アラビニトールの生合成[d]。『江蘇大学,25 2022年。
[28] jagtap s s, rao c v .油性酵母rhodosporidium toruloides ifo0880によるダラビトールのフロムキシロース生産[j]。応用微生物学とバイオテクノロジー- nology, 2018,102(1):143-151。
[29] yoshikawa j, habeh, morita t, et al。生のグリセロールからのダラビトールの生産による Candida quercitrusa [J]。 適用 微生物学 and 2014年バイオテクノロジー、98(7):2947-2953。
[30] wang huilian, yang lianwan, na shumin, et al。高浸透圧耐性酵母によるグリセロールやアラビトールの生産に関する研究iii。zygosaccharomyces chevalieri guillによるグリセロールの生産のための条件。2.309 [j]。^『キネマ旬報』キネマ旬報社、1963年(昭和38年)、92-93頁。
[31] toyoda t, ohtaguchi k . lactose on darabitol production on kluyveromyces lactis on lactose [j]ラクトースとラクトースの関係[j]ラクトースとラクトースの関係。applied microbiology and biotechnology, 2010, 87(2):691-701。
【32】孫文道、徐輝、劉建軍。d-アラビトールの発酵に対する添加物の影響[j]。food science and technology, 2013, 38(06): 12-16。
[33] qi x, zhang h, magocha t a, et al。分離されたgluconobacter sp. jx-05および細胞全体のco-bi- otransformationからノベルダラビトールデヒドロゲナーゼを発現させることでキシリトール産生を改善[j]。Bioresour技術235:50-58、2017年であり、
[34] ravikumar y, ponpandian ln, zhang g, et al。dtagatoseの生物学的生産のためのl-アラビノースイソメラーゼの利用:最近の進歩とその応用[j]。食品科学のトレンド&技術、2021年107:16-30。
[35] koganti s, ju l . debaryomyces hanseniiアラビトール生産のための発酵[j]。^『日経産業新聞』1979年9月1日、119 -119頁。
[36] song weibin, lin yanqing, hu haiyan, et al。d-アラビトール生産株のスクリーニングと同定およびd-アラビトール生産条件の最適化[j]。^『仙台市史』通史編1(仙台市史)、339 -339頁。
[37] song weibin, lin yanqing, hu haiyan, et al。新規カンジダの単離と同定sp. h2製造ダラビトールダラビトール生産の最適化[j]。2011年魏胜吾薛鉉宝、51(3):332-339。
[38] sundaramoorthy b, gummadi sn。アラビトール生産のための新種酵母pichia manchuricaのスクリーニング[j]。日本微生物学会誌,2019,59(3):256-266。
[39] kumdam h、narayana m s、gummadi s n . debaryomyces nepalensisによるエタノールとアラビトールの生産: 影響 プロセスパラメータ [J]。 AMB 特急、2013年、3(1):23-28。
[40] loman a a, islam s, ju l k . debaryomyces hansenii発酵によるきな粉の酵素加水分解物からのアラビトールの生産[j]。^「applied microbiology and biotechnology, 2018,102(2):641-653」。applied microbiology and biotechnology(2018) . 2018年3月14日閲覧。
[41] zhu h y, xu h, dai x y, et al。新たに単離されたko - damaea ohmeriによるダラビトールの生産[j]。^ a b「bioprocess and biosystems engineering, 2010,33(5)」。bioprocess and biosystems engineering (2010) . pp . 565-571. 2010年3月25日閲覧。
[42] kumdam h、murthy s n、gummadi s n . debaryomycesによるエタノールおよびアラビトールの生産 nepalensis: 影響 of process パラメータ[J]。 AMB 2013年急行、3(1):年1月~ 12月。
[43] ehrensberger ah, ellingra, wilson dk。キシリトールデヒドロゲナーゼ共基質特異性の構造誘導工学[j]。2006年構造、14(3):567-575。
[44]元Junhua。clostridium butyricumの1,3-プロパンジオールデヒドロゲナーゼを用いた遺伝子組み換え細菌の構築と1,3-プロパンジオールの全細胞生合成[d]。江苏の大学。
[45] chen gaoyun, ye kai, tu zhendong, et al。キシリトールデヒドロゲナーゼの研究[j]。^「science and technology」。science and technology(2011年). 2011年4月5日閲覧。
[46]張Huanhuan。gluconobacter oxydansからのキシリトールデヒドロゲナーゼおよびエタノールデヒドロゲナーゼ遺伝子のクローニングおよび発現およびキシリトールの細胞全体生合成[d]。『江蘇大学,25 2018年。
[47] sugiyama m, suzuki s, tonouchi n, et al。gluconobacter oxydansからのキシリトールデヒドロゲナーゼ遺伝子のクローニングとキシリトールfromdの産生の改善 arabitol [J]。bioscience, biotechnology and biochemistry, 2003,67(3):584-591。
[48] zhang j, li s, xu h, et al。キシリトールデヒドロゲナーゼを精製し、グルコノ-バクテロキシダンにおけるxdh活性とnadh供給を増加させることによるキシリトール生産の改善[j]。2013年の農産物や食品化学の雑誌、61(11):2861社で- 2867。
[49] qi x, zhu j, yun j, et al。強化されたキシリトール産生:gluconobacter oxydansからのキシリトールデヒドロゲナーゼの発現および休息細胞の混合培養[j]。日本生物工学会誌,2016,122(3):257-262。
彭[50]河だ。ステロイドp450ジヒドロキシラーゼcyp-cl3の触媒効率向上の分子修飾と機構解析[d]。江南大学、2022年。
[51]「羅老号和彦が决定。gluconobacter thailandicus dのアラビトールデヒドロゲナーゼおよびキシリトールデヒドロゲナーゼ遺伝子のクローン・共発現[d]。2016年江苏の大学に决定。
(52]張Yufei。lactobacillus reuteriによる3-ヒドロキシプロピオン酸と1,3-プロパンジオールの共産に関する研究[d]。江苏の大学だわ
[53]元焦。建設基づく遺伝子組み換え細菌のβ-galactosidaseとL-arabinose異性化酵素と生D-tagatose [D] .江苏の大学だわ


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本