dタガトース粉末の合成法?
人間は一日三食に砂糖なしでは済まない。砂糖の適切な量を食べるだけでなく、体のニーズを満たしています'の機能だけでなく、幸福感をもたらします。しかし、生活水準の向上に伴い、砂糖の消費量が増え、肥満、糖尿病、虫歯、心臓病などの疾患が増加しています[1]。近年では、吸収率が高くカロリーの高い従来の糖(ショ糖、白糖、ブドウ糖など)から、低カロリーで吸収率の低い希少糖(キシリトール、エリトリトール、d-アルロースなど)への転換が進んでいます。国際希少糖学会(isrs)は、希少糖を、自然界に存在するが非常に少量の単糖およびその誘導体であると定義しています[3]。希少糖は甘いだけでなく、低カロリーです。さらに重要なことは、彼らは人間の健康に有益な生理機能を持っており、大きな発展の見通しを持っています。
Rare sugar D-tagatose分子式c6h12o6、分子量180.16で、構造式は図1に示す。d-ガラクトースの異性体、c-3位のd-ソルビトールのジアステレオ異性体、c-4位のd-フルクトースのジアステレオ異性体である。白色の結晶性顆粒または白色粉末,水に溶けやすいです,エタノールに溶けにくいです。天然に存在する低カロリー機能甘味料で、甘味はショ糖の92%[4]で、カロリー値は1.5 kcal/g[5]です。d-タガトースは、米国食品医薬品局(fda)によって安全な(一般的に安全な、grasとして認識される)成分として承認されています[5 - 7]。2014年China'の国家保健・家族計画委員会は、新しい食品成分としてd-タガトースを承認した[6]。d-タガトースは、虫歯や肥満を予防したり、血糖値を下げる効果があるだけでなく、腸の健康にも効果がある[8]。
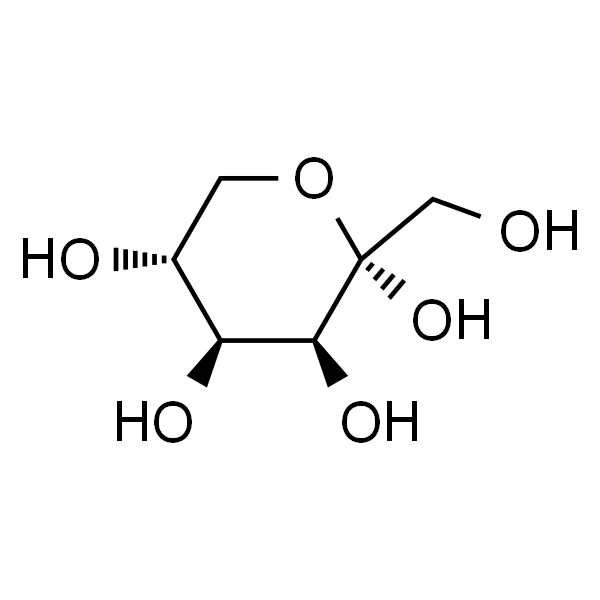
本論文では、d-タガトースの生理機能とその応用について簡単に説明し、d-タガトース生合成に必要な主な生物学的酵素を紹介し、近年のd-タガトース生合成の研究成果をまとめ、d-タガトース生合成の展望を述べる。
1 d-タガトースの生理機能と応用
1.1メイラード反応を受けることができ、食品に使用される低カロリーの甘味料
D-tagatoseis a low-calorie sweetener. It is 92% as sweetas sucrose, but only 37.5% as 高いでcalories (4kcal/g) [5]. It cのreact とproteins in food にform a Maillard reaction, which improves のcolour とflavour ののfood. It is therefore used in baked goods, drinks とconfectionery.
1.2肥満を防ぎ、血糖値を下げ、2型糖尿病の治療に役立ちます
d-タガトースは、スクロースなどの従来の甘味料の代替として食品に使用できる低カロリーの機能性甘味料です。肥満を緩和し、血糖値を下げることができます[9]。医学・医療分野では、2型糖尿病や肥満の治療薬としてd-タガトースが用いられている[10-12]。
1.3腸の健康に有益な優れたプレバイオティクス
d-タガトースは大腸内の腸内細菌叢によって発酵させることができ、腸内の有益な腸内細菌の増殖を促進し、腸内の病原性細菌の増殖を阻害する[13]。さらに、d-タガトースの発酵は、腸の健康に有益な酪酸などの短鎖脂肪酸を生成することができます。これらの酸は、結腸上皮細胞の増殖と再生を促進し、結腸がんの発生を抑制する[14]。
1.4抗う蝕,歯の健康を保護するために有益
d-タガトースは、口の中の微生物には利用できないため、口の中の酸性物質の産生を減少させ、虫歯を減少させ、歯肉炎、虫歯、口臭などの歯科疾患の発生を効果的に防ぐことができる[13]。

1.5他の希少な糖アルコールを生成する基質として使用される
d-タガトースを出発点として、適切な酵素反応により、d-ソルビトール、d-タガトース、ガラクチトールといった重要な生理機能を有する希少糖アルコールが得られる(図2)。
2 d-タガトースの製造法
2.1自然抽出法
自然に存在するd-タガトースは、主に熱帯常緑樹、コケ、地衣類、ホットココア、チーズ、ヨーグルトの歯茎に見られ、含有量は非常に小さい[13,16,17]。これらの物質からd-タガトースを直接抽出するには、大量の原料を必要とするためコストが高く、工業的な生産が困難である。
2.2化学合成法
d-タガトースは、d-ガラクトースから化学合成によって得られる。使用される化学触媒はアルカリ金属塩であり、d-ガラクトースと水酸化物との異性化反応を触媒して金属水酸化物- d-タガトース錯体を形成する。酸が中和されると、複合体からd-タガトースが放出されます[13,14,18]。しかし、d-タガトースの化学合成法は比較的複雑であり、副生成物を生成しやすいため、目的のd-タガトースの純度が低下し、後から分離精製することが困難である。また、化学試薬の使用は環境負荷の原因となり、グリーン生産の概念にも合致しない[19]。
2.3 Biosynthetic方法
主に2つの方法があります合成生物学的D-tagatose1つは単一の酵素反応を用いてd-タガトースを合成する方法、もう1つは多酵素反応を用いてd-タガトースを合成する方法である。izumoring strategy(図2)によれば、適切な単一のアルドースイソメラーゼ、d-タガトース- 3-エピメラーゼ、およびレダクターゼを選択して、それぞれd-ガラクトース、d-ソルビトール、およびガラチトールをd-タガトースに変換することができる。しかし、d-ガラクトース、d-ソルビトール、およびガラクチトールの価格が比較的高いため、工業生産に適用することが難しく、d-タガトースの工業生産が制限されている。現在、ラクトース、マルトデキストリン、乳粉などの低コスト基質を出発物質として選択し、多酵素触媒反応を用いてd-タガトースを合成し、いくつかの研究成果を上げている。d-タガトース生合成法は、生産効率が高く、生成物の純度が高く、反応条件が穏やかで、コストが安いという利点があり、d-タガトースの工業生産に適している[20]。
3単酵素反応によるd-タガトースの合成
3.1 l-アラビノースイソメラーゼはd-ガラクトースからd-タガトースへの合成を触媒する
希少糖を生合成する単一酵素法は、酵素の物理化学的性質を十分に利用することができ、希少糖の生産に応用されています。簡便で効率が良く、酵素触媒の利用率が高く、生産効率が高いという利点がある。l-アラビノースイソメラーゼ(l-ai)はd-タガトースの生合成のために現在最も研究されている酵素であり、d-ガラクトースをd-タガトースに触媒することができる。
この酵素は、acidothermus cellulolyticsatcc43068[21]、bacillus subtilis str. 168[22]、lactobacillus sake i 23 k[23]、lactobacillus fermentumなど、幅広い微生物源を有する CGMCC2921[24]、菌 thermoglucosidasius KCTC 1828年(25)Alicyclobacillus hesperidum urh17-3-68[26]、bacillus coagulans nl01[27]、pseudoalteromonas haloplanktis atcc 14393[28]、geobacillus [4]stearothermophilus、 クロストリジウム hylemonae DSM 1505 3[29]、lactobacillus brevis mf 465792[30]、enterococcus faecium dbfiq e36[31]、bifidobacterium adolescentis cicc 6178[32]、klebsiella pneumoniae dsm 681[33]など。
The enzymatic properties のL-arabinose異性化酵素からのabove microorganisms are shown in Table 1. The optimum reactiにtemperature is between 40-75 ℃, のoptimum reactiにpH is between 5.0-8.0, とvarious metal ions are activators のthe enzyme, such as Mn2+, Co2+, and Mg2+. Most L-AIs have 基板特異性ためL-arabinoseand D-galactose, while a small number have substrate specificity only ためL-arabinoseand no substrate specificity ためD-galactose, such as L-AIs から菌subtilis str. 168[22] and Pseudoalteromonas haloplanktis ATCC14393[28]. specificity, such as L-AI から菌subtilis str. 168[22] and Pseudoalteromonas haloplanktis ATCC 14393[28]. In addition, L-AI enzymes からAcidothermuscellulolytics ATCC43068[21], Lactobacillus sakei 23K[23], Lactobacillus fermentum CGMCC2921[24], Bifidobacterium adolescentis CICC 6178[32], etc. exhibit strong substrate specificity ためD-galactose.
bacillus coagulans nl01由来のl-aiは、大腸菌発現系で不均一に発現し、60°cおよびph 7.5で全細胞によって触媒された。基質のd-ガラクトースの濃度を150 g/ l、250 g/ lとしたとき、得られたd-タガトースの変換速度はそれぞれ32%と27%であり、変換時間はそれぞれ32時間と48時間であった[27]。100 mmol/ lのd-ガラクトース(6 mmol/ l mn2 +を含む)をビフィズス菌(bifidobacterium adolescentis cicc 6178)の精製l- ai酵素で55°c、ph 6.5で10時間触媒すると、d-タガトース変換率は56.7%であった[32]。klebsiella pneumoniae dsm 681由来のl-aiは、大腸菌の発現系で不均一に発現していた。基質は100 g/ l d-ガラクトース(1 mmol/ l mn2 +を含む)であった。全細胞触媒反応を50°c、ph 8.0で30分間行い、d-タガトースの変換率は33.5%であった[33]。
胞子表面表示技術は、標的酵素と胞子表面タンパク質を融合させて、その酵素を固定化することで、胞子表面に標的酵素を表示させる技術です。固定化酵素は、極端な環境下でも触媒活性を維持し、基質と生成物の膜透過の障壁を克服することができる[10]。酵素の固定化のための有益な試みである。2014年、柳 [16]らは、芽胞表面表示技術を用いて、枯草菌168個の芽胞の表面にlactobacillus fermentum cgmcc2921のl- ai酵素を表示した。得られた組換えl- ai胞子は、比較的高い触媒活性と高い熱安定性を示した。80°cで30分間保存した後も、酵素活性の87%は維持された。
この組換えl- ai芽胞を生体触媒として、100 g/ lのd-ガラクトースを基質とし、70°cで24時間反応を行い、d-タガトースの変換率は約75%であった。guoらは2018年にも、芽胞表面表示技術を用いて、枯草菌db403の芽胞の表面にブレビスpc16由来のl- ai酵素を表示した[10]。組換えl- aiの胞子をバイオ触媒として用いた。125 g/ lのd-ガラクトース(1 mmol/ l mn2 +含有)を基質として、6 7°c、ph 6.5、28時間で反応を行ったところ、d-タガトースの変換率は79.7%であり、l-ai組換え芽胞の再利用性が良好であった。5サイクル経過後も特異活性は87%であり、d-タガトースの変換率は40.7%であった。胞子表面表示技術は、胞子の歩留まりが低いという欠点があり、工業的な応用が困難でした。表2に、d-ガラクトースからのd-タガトースの触媒合成に関する前述の文献報告をまとめた。
熱力学的平衡の限界のため、イソメラーゼ触媒反応の特徴は低い変換速度であり、これは生産効率を低下させ、生成物の分離・精製には寄与しない。反応温度を上げると反応平衡を生成物側にシフトさせることができますが、過度に高い温度は酵素活性を低下させるだけでなく、糖分の褐変を引き起こし、特にアルカリ性条件下で製品品質に影響を与えます。したがって、低反応温度、酸性反応ph、高い触媒活性、高い耐熱性を有する酵素触媒の開発は、産業用途に有用である。
3.2 d-タガトース3-エピメラーゼは、d-ソルビトールからd-タガトースを生成する触媒である
d-タガトース3-エピメラーゼ(d-タガトース3-epimerase、dte)またはd-プシコース3 -エピメラーゼ(d-プシコース3 -epimerase、dpe)は、d-プシコースの生合成に用いられる酵素である。幅広い基質特異性を持っています。あっ、例えばもよいから酵素Agrobacterium tumefaciens (34) Arthrobacter globiformis(35)・DTE Caballeronia由来の酵素によりfortuita[36]持ってたん変換●Tagatose D-sorbitolとDでD-sorbitolにD-Tagatose均衡の割合は30.7:69.3によりbiocatalyzed DTE Caballeronia由来の酵素によりfortuita(図3)。しかし、煤油炉に関する研究がほとんどなかったD-sorbitolからD-Tagatose生産費が高くて採算が取れ、D-sorbitolがd-タガトースの工業生産 からD-sorbitol uneconomical.
3. 3ガラクチトール脱水素酵素は、ガラクチトールからd-タガトースを生成する触媒である
ガラクチトール- 2-デヒドロゲナーゼ(gdh)は、補酵素nad +の存在下で様々な多アルコールやポリオールをそれぞれケトンやケトースに酸化することができる。[37] rhizobium leguminosarum bvからgdh酵素を不均一に発現。viciae 3841 -大腸菌の発現系。
gdh酵素タンパク質はhis-tagアフィニティークロマトグラフィーを用いて精製された。ナトリウムdodecyl sulfate-polyacrylamide通称『绞電気泳動は分子量を決定する酵素の28 kDaジェル濾過クロマトグラフを用いていた分子量を決定する酵素で114 kDa酵素はhomotetramerを示唆した。酵素の特性を分析した結果、最適温度は35°c、最適反応phは9.5であった。基質がガラチトールの場合、速度パラメータkmは8.8 mmol/ l、kcatは835 min-1、kcで/ kmは94.9 min-1mmol・l-1であり、酵素がガラチトールに対して良好な基質特異性を持っていることを示している。g dh酵素は30分間ガラクチトール反応を触媒し、d-タガトースの変換率は72%と高い。光学回転を測定することにより、酸化生成物がd-タガトースであることが確認される。
galactitol dehydrogenaseを用いてgalactitolからd-タガトースを生成する触媒を用いることで高いd-タガトース変換速度を得ることができるが、この酸化反応には補酵素nad +の付加が必要であり、基質のgalactitolは高価であるため工業生産の原料として経済的ではない。
4 多酵素触媒による安価な基質からのd-タガトース合成を触媒する
4. 1 ラクトースからd-タガトースを生成する触媒
ラクトースは1分子のd-グルコースと1分子のd-ガラクトースからなる2糖である。d-ガラクトース、d-ソルビトール、およびガラクチトールよりも価格が低いため、d-タガトースの生産に好適な基質である。zhangら[38]はlactiplantibacillus plantarumを構築した エンジニア株を使ってガラクトキナーゼ遺伝子をノックアウトし、d-ガラクトースの代謝を阻害する。表しβ-galactosidase(β-g galactosidase、β-GAL)とL-arabinose異性化酵素、どの同時にD-galactoseD-tagatoseにことD-tagatoseの直接の生に含まれる乳糖から植木鉢組み換え。この仕組みを利用し、株が65歳で携帯反応も休んで使っ°C pH 7.5 56 h aの基板175 g / L乳糖、リンコマイシン展開D-tagatoseの蔵置率は33%だった。
4. 2. ホエイ粉末からのd-タガトースの触媒生産
乳業廃棄物は希少糖製品の安価な原料として利用される[39,40]。2022年、張ニュースを[41]ら、変換の副産物であるlactose-rich乳チーズ乳清粉(CWP) 3低カロリー甘味料にD-tagatose、D-arabitol galactitol、を连続whole-cell煤油炉、発酵(図4)て、先組み換えで大腸菌株co-expressingβ-galactosidaseとL-arabinose異性化酵素に使用されたhydrolyze CWPに含まれる乳糖D-galactoseとブドウ糖とisomerize D-galactoseD-tagatose。その後、d-グルコースと残りのd-ガラクトースはmetschnikowia pulcherrima e1によってd-アラビトールとガラチトールに発酵される。最後に68.35 g/ l d-タガトース60.12 g / L D-arabitolまた、428.57 g/ l cwp (300 g/ lのラクトース含有)を用いて、28.26 g/ lのガラチトールが得られた。また、中間代謝物であるd-グルコースとd-ガラクトースを完全に利用し、工業副産物から有用な一連の生成物を作り出した。
4.3マルトデキストリンからのd-タガトースの触媒生産
20年22戴国らた[42]体制が築かれてα-glucのphosphorylase(α-glucan phospho-lyase、最前線監視哨戒所αGP)、phosphoglucomutase (PGM)、ブドウ糖6-phosphate異性化酵素(PGI) D-tagatose1ビスリン酸aldolase (GatZ)とphosphoglycolateホスファターゼ(PGP)。ホスファターゼ(pgp)は、大腸菌の全細胞バイオ触媒から構成される。さらに、crispr-cas9技術を用いて中間生成物の代謝を引き起こす遺伝子をノックアウトし(図5)、中間生成物の蓄積を増加させました。作製された大腸菌株をバイオ触媒として用い、10 g/ lのマルトデキストリンを3時間基質として用い、33.83 g/ lの変換率で3.383 g/ lのd-タガトースを得た。
Multienzyme promoted reactions have great potential in terms のbiosynthesis and conversion. Compared with single-enzyme-promoted reactions, multi-enzyme-promoted reactions can achieve more complex reactions, 生産high value-added products からlow-cost substrates, avoid the 分離of intermediates, reduce the inhibition of intermediates, and even change the reaction balance [5]. However, due にthe unbalanced ratio of various enzymes, the unbalanced metabolic flux of intermediates, and the different optimal reaction conditions of various enzymes, the 変換rate D-tagatoseのis not high. In the later stage , it is possible to use techniques such as synthetic biology, metabolic engineering, and protein engineering to optimize enzyme synthesis and 表情improve enzyme performance, increase the synergy between various enzyme molecules, and improve the conversion rate of D-tagatose.
5 d -タガトースの分離、精製、結晶化
d-タガトースの分離・精製は、その後のd-タガトースの結晶化と製品品質に影響を与える重要なステップである。2008年にhuang wenxiaらは、ca2 +イオン交換樹脂を用いてd-ガラクトースとd-タガトースを分離し、得られたd-タガトースの純度は98%、回収率は83%であると報告した。得られたd-タガトース溶液をアニオンとカチオンの交換樹脂で脱塩および脱色させ、脱塩率93%、d-タガトース回収率87%を得た。その後、エタノールを添加してd-タガトースを結晶化させた。su qiらは、模擬動床クロマトグラフィーを用いてd-タガトースとd-ガラクトースを分離し、バルブの切り替え時間を6.43分にしたところ、分離したd-タガトースの純度は100%に達し、回収率は99.93%に達した[44]。近年、シミュレーテッドムービングベッドクロマトグラフィーは、高い分離効率、高い溶剤使用率、低いエネルギー消費などの利点から、希少糖の製造に広く利用されています。
At present , there have been few reports on the 結晶of D-tagatose. The biosynthesis of D-tagatoseis prone to the 生産of other heterosaccharides (such as D-glucose, D-fructose, etc.), and they often cannot be completely removed during industrial separation, which affects the nucleation and growth D-tagatoseのcrystals, as well as the morphology, particle size distribution and purity of D-tagatose crystals. In 2022 , 王etアル[45] studied the effect of three impurity 糖類(D-maltose, D-fructose, and D-glucose) on the nucleation rate of D-tagatose crystals and found that the adsorption 穢れsugars on the surface of D-tagatose crystals hinders the growth of D-tagatose crystals (Figure 6). WANG etアルalso studied the effect of impurity sugars on the growth rate of D-tagatose crystals through single crystal growth experiments, and used molecular dynamics simulations to reveal the crystal nucleation and growth mechanism of D-tagatose at the molecular scale. There are currently few reports on the industrial crystallization process of D-tagatose.
6概要と展望
As a functional natural sweetener, D-tagatose not only has important application value in the food industry, but also plays a vital 役割in the pharmaceutical and healthcare industries. Although D-tagatose has been approved as a new food ingredient in China, large-scale production has not yetbeen realized for the following reasons: (1) an enzyme catalyst with high production intensity, strong thermal stability and high conversion rate has not yetbeen obtained; (2) insufficient development of food-grade host bacteria; (3) high substrate cost; (4) high difficulty in product separation and purification.
以上の理由から、以下の研究を重視することをお勧めします。(1)タンパク質工学、酵素工学などの技術を用いて酵素の分子構造を修正し、高い触媒活性、高い変換率、高い熱安定性を持つ酵素分子を得る;(2) bacillus subtilis、酵母酵母、乳酸菌などを含む、生物触媒キャリアとしてgras認証を取得した食品グレードの宿主細菌を開発する;(3)生合成と変換における多酵素触媒の潜在力を十分に発揮し、各種酵素分子の発現レベルと中間代謝流のバランスをとり、各種酵素分子間の相乗効果を高め、低コストの基質を利用してd-タガトースを大量生産する。(4) d-タガトースの分離・精製・結晶化プロセスの最適化。これらの取り組みにより、d-タガトースの工業生産のためのシンプルで効率的かつ革新的なプロセスルートが確立された。
参考:
[1] SURAPUREDDI s ravindhranath k kumar g らキャピラリー電気泳動を用いたd -タガトースおよびプロセス関連不純物の高分解能・高スループット分析法[j]。analytical biochemistry, 2020, 609: 11398 1。
[2] baptista s, romania, oliveira c, etal。bacillus subtilis由来のl-アラビノースイソメラーゼによるガラクトースからタガトースへの異性化:gelidium sesquipedale valorisationのためのバイオリファイリーアプローチ[j]。lwt-food science and technology,15, 2021,151: 112199。
[3] beerens k, desmett, soetaert w .希少糖の生体触媒生成酵素[j]。2012年誌『産業微生物とバイオテクノロジー、39(6):823-834。
[4] 吉祥天 F 新井 S 鶴丸 H et アル 改善 substrate specificity for D-galactose of L-arabinose 異性化酵素 for 産業応用[J]。biochimica et biophysica acta (bba) - proteins and proteomics, 2018, 1866(11): 1084-1091。
[5] dai y, li m, jiang b, et al。多酵素共発現系を用いた大腸菌改変法によるマルトデキストリンからのd-タガトースの全細胞生合成[j]。酵素微生物技術、2021年まで、145:109747。
[6] wang j .甘味料d-タガトースの製造と食品への応用[j]。中国調味料,2016,41(01):140-143。
【7】 ^ a b c d e f g h i j j j j j j j j j j j j j j j j j j j j アルtagatose as a potential nutraceutical: production, properties, biological roles, and applications[j]。日本食品学会誌,2018,83(11):2699-2709。
[8] 新井吉祥天F s, arakawa t, et al。l-アラビノースイソメラーゼの発現と特性 酸性条件下での活性改善のためのgeobacillus stearothermophilus [j]。蛋白質の発現と精製、2020年、175:105692。
[9] BOBER JR ナオル 汉委奴。 半乳糖 to tagatose isomerization at 適度な 気温 with high conversion and 生産性か[J]。nature communications, 2019, 10(1): 4548。
[10] guo q, an y, yun j, et al。単離されたlactobacillus brevis pc16およびbiotransformationからの芽胞表面表示されたl-アラビノースイソメラーゼによるd-タガトース産生促進[j]。^「bioresource technology」。bioresource technology(2018年). 2018年4月24日閲覧。
[11] de sousa m, melo v, hissa d, et al。組換えenterococcus faecium dbfiq e36l - d-タガトース合成のためのアラビノスイソメラーゼの一段階固定化と安定化[j]。applied biochemistry and biotechnology, 2019, 188(2): 310 -325。
[12] de souza t, oliveira r, bezerra s, et al。enterococcus faecium dbfiq e36由来の残留ホエールラクトース誘導によるl-アラビノスイソメラーゼの異種発現[j]。^ a b c d e f g h i(2017年)、49 - 49頁。
[13] dai y .マルチ酵素触媒系によるマルトデキストリンからのd-タガトース生合成[d]。江南大学、2021年。
[14]郭q .の生産を使用して乳糖からD-tagatoseβ-galactosidaseとL-arabinose異性化酵素」[D] .山大学,2018。
[15]泉守和彦泉守:全ヘキソースの生物生産戦略[j]。^「journal of biotechnology, 2006, 124(4)」。journal of biotechnology(2006) . 2017年4月7日閲覧。
[16] liu y, li s, xu h, et al。食品グレードの表面表示システムを用いたd-タガトースの効率的な生産[j]。農業・食品化学誌,2014,62(28):6756-6762。
[17] zheng z, xie j, liu p, et al。チーズホエイ粉末からのd-タガトースとバイオエタノールの二重生産のためのエレガントで効率的な生体変換[j]。農業・食品化学,2019,67(3):829 -835。
[18] wang z, wang m, lyu x, et al。ワンポットボロン酸親和性吸着剤による吸着補助異性化と同時精製によるガラクトースからの高純度タガトースのリサイクル調製[j]。^『官報』第2034号、大正8年4月22日、476頁。
[19] BORTONE N FIDALEO M。 安定 のスナイパー L-arabinose 異性化酵素 for the production of D-tagatose from D-galactose [J]。^ a b c d e f g h i『人事興信録』第6版、363頁。
[20] de sousa m, silva gurgel b, pessela b, et al。d-タガトース合成のための組換えl -アラビノースイソメラーゼのクリートおよび磁気クリートの作製[j]。酵素と微生物技術、2020年、138:109566。
[21]成 L ムー W 張 T, et アル の L-arabinose 異性化酵素 from Acidothermus cellulolytics ATCC 43068: 、クローン 表現、浄化、および特性[j]。応用微生物学とバイオテクノロジー,2010,86(4):1089 -1097。
[22]金 J PRABHU P JEYA M et アル 特性化 of an L-arabinose 異性化酵素 from Bacillus 耐熱性[J]。 適用 微生物学 and biotechnology, 2010, 85(6): 1839-1847。
[23] rhimi m, ilhammami r, bajic g, ら酸に耐性のあるl-アラビノースイソメラーゼです 食品グレードのlactobacillus sakei 23 kは魅力的なd-タガトース生産者である[j]。」。bioresource technology, 2010, 101(23): 9171 -9177。
【24】xu z, qing y, li s, et al。lactobacillus fermentumの新しいl-アラビノースイソメラーゼ d-タガトース産生のためのcgmcc2921:遺伝子クローニング、精製および特性評価[j]。journal of molecular catalysis b: enzymatic, 2011, 70(1): 1 -7。
ソ。[25] M。 特性化 of an L-arabinose 異性化酵素 from Bacillus thermoglucosidasius for D-tagatose 生産か[J]。 ^「bioscience biotechnology and biochemistry, 2013, 77(2): 385-388」。bioscience . 2013年3月28日閲覧。
[26] fan c, liu k, zhang t, et al。熱アシドーフィルス性細菌alicyclobacillus hesperidum urh17-3-68由来の熱安定性l-アラビノースイソメラーゼの生化学的特徴[j]。the journal of molecular catalysis b: enzymatic, 2014, 102: 120-126。
[27] mei w, wang l, zang y, et al。bacillus coagulans nl01由来のl-アラビノースイソメラーゼの特性とd-タガトース産生への応用[j]。2016年(平成28年)1月1日:ダイヤ改正。
[28]徐 W ファン C 張 T, et アル 、クローン expression, and 特性化 の 小説 L-arabinose 異性化酵素 from the 精神耐性細菌pseudoalteromonas haloplanktis[j]。2016年分子生物58(11):695-706。
[29]グエン T, 洪 M 長 P et アル バイオ特性 L-arabinoseの 異性化酵素 from クロストリジウム hylemonae to produce d -機能性甘味料としてのタガトース[j]。^ plos one, 2018,13(4): e0196099。
[30] du m, zhao d, cheng s, et al。d-ガラクトースからd-タガトースへの効率的な酵素変換に向けて:lactobacillus brevisからのl-アラビノースイソメラーゼの精製と特性評価[j]。バイオプロセスと生体システム工学,2019,42(1):107 -116。
[31]万蔵 R, A ANTUNES DE スーザM et al. バイオ 特性化 のheat-tolerant组换え L-arabinose isomerase enterococcus faecium dbfiq e36株からd-タガトース生産に応用可能[j]。分子バイオテクノロジー2019,61(6):385 - 399。
[32] zhang g, an y, parvez a, et al。ビフィズス菌adolescentisからd-タガトース産生のためのd-ガラクトース特異的なl-アラビノースイソメラーゼの探索[j]。^「bioengineering and biotechnology」。bioengineering and biotechnology(2019年). 2019年3月8日閲覧。
[33] shin k, seo m, kim s, et al。klebsiella pneumoniae由来のl-アラビノースイソメラーゼの特徴とd-ガラクトースからのd-タガトース生産への応用[j]。^『官報』第2026号、大正9年(1920年)12月26日。
[34]キム・h、ヒョンエ、キム・y らd-フルクトースをd-プシコースに変換するアグロバクテルムtumefaciens d-psicose 3-エピメラーゼ[j]。2006年環境微生物学を適用し、72(2):-985 981。
[35] yoshihara a, kozakai t, shintani t, et al。d -alluloseの精製と特性化 gras微生物arthrobacter globiformis m30由来の3-エピメラーゼ[j]。journal of bioscience and bioengineering, 2017, 123(2): 170 -176。
[36] li s, chen z, zhang w, et al。d -タガトース3-エピメラーゼの特徴 カバイロニア・フォルトゥイータと希少糖生産への応用[j]。international journal of biological macromolecules, 2019,138: 536 -545。
[37] jagtap s, singh r, kang y, et al。rhizobium legumenosarumからのgalactitol 2-デヒドロゲナーゼのクローニングと特性評価とd-タガトース産生への応用[j]。酵素と微生物の技術,2014,58 -59:44-51。
[38] zhang s, guo t, xin y, et al。代謝工学lactiplantibacillus plantarumを用いたラクトースからのd-タガトースのバイオ生産[j]。LWT -食品の科学技術、2021年まで、142:110995。
[39] rai s, kaur h, kauldhar b, et al。ホエイラクトースから希少糖d-タガトースへの直接変換を可能にする二酵素金属ハイブリッド結晶:合成、特性評価、持続可能なプロセス[j]。^ a b c d e f g h i「science and engineering」。acs biomaterials science and engineering, 2020, 6(12): 6661—6670。
[40] zhang g, zabed h, yun j, et al。lactobacillus plantarum由来のl-アラビノースイソメラーゼを発現する大腸菌株を操作して、乳ホエイ粉末からd-タガトースを二段階生合成する[j]。バイオリソース技術、2020、305:123010。
[41] zhang g, zabed h, an y, ら連続的な全細胞および発酵技術を用いた、乳糖豊富な乳製品廃棄物のd-タガトース、d-アラビトールおよびガラクチトールへの生物触媒変換[j]。^「bioresource technology, 2022, 358: 127422」。bioresource technology . 2018年3月23日閲覧。
[42] dai y, li c, zheng l, et al。組換え大腸菌のモジュラーパスウェイ工学によるマルトデキストリンからのd-タガトース生合成の増強[j]。^『日経産業新聞』2018年8月18日、178頁。
[43] huang w, mu w, jiang b . d -タガトースの分離・精製に関する研究[j]。^「food and fermentation industries, 2008, 34(06):168-171.」。food and fermentation industries(2008年). 2008年4月1日閲覧。
[44]蘇 Q 李 H 札差 X, et al. シミュレーション 研究 on separation of D-tagatose and D-galactose in 模擬 移動 か[J]寝た。 現代化学工業、2014年、43(07):1379-1381+1385。
[45]王 D WANG Y 李 Y et al. 究明 the role of impurity sugars on the crystallization of D-tagatose 水晶: 実験 分子動力学シミュレーション[j]。食品化学、2022、397:133762。


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本




