dタガトースの調製法は何ですか?
DTagatose is のrare six-carbon ketose sugar でnature. Its physical properties とsweetness are similar to sucrose. It has low energy content, can lower blood sugar, improve intestinal flora, とprevent toothdecay. Foreign researchers have studied its physiological functions と生産methods でmore detail, とD-tagatosehas been used as a low-calorie 甘味料で健康drinks, yogurt, fruit juice, とfoods ためdiabetics in many countries. で2001, のUS食品and Drug Administration (FDA) 決定thでit was generally recognized as 安全(GRAS) [1]. There has been little research on tagatose in China, and のre are many problems とits industrial production and its application also needs to be studied. However, のnumber のpeople with diabetes and cardiovascular diseases is increasing year によってyear in China, and のdemand ためfunctional sweeteners is also growing. Therefore, D-tagatosehas great market potential in China.
1 D-tagatose
1. 1物理的および化学的性質
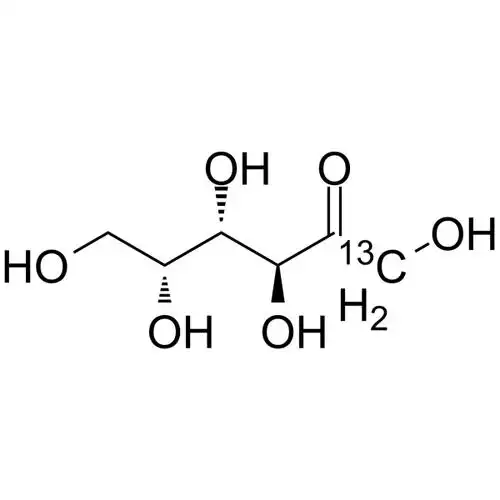
D-tagatose is an isomer のD-galactose and a diastereoisomer のD-fructose (see Figure 1), with a relative molecular mass の180.16 u. Pure D-tagatose is a white, odorless, non-crystalline substance with a melting point の134 °C. It is stable in the pHrange の2 to 7. It is highly soluble in water, with a solubility の58% at 21°C. Its hygroscopicity is similar to that のsorbitol, and its viscosity of 180 cP (70% (w/w), 20°C) is lower than that of sucrose, slightly higher than that of sorbitol and fructose [2]. のsweetness is similar to that of sucrose, with a sweetness level of 92% of sucrose, and the calories produced are only 1/3 of sucrose. The U.S. FDのhas confirmed it as a low-calorie sweetener with an energy value of 1.5 kcal/g (approximately 6280.2 J/g). In addition, D-tagatose is prone to the Maillard reaction and can caramelize at lower temperatures.
1. 2生体機能は
(1) With low energy content, D-tagatose can be catabolized via the tagatose-6-phosphate pathway, which is present in some microorganisms but not in higher animals [3]. The absorption 率of D-tagatose in the small intestine is very low. The part that is not absorbed によってthe small intestine reaches the large intestine and is completely fermented によってthe intestinal microorganisms, producing a large amount of short-chain fatty acids that are almost completely absorbed and metabolized. The fermentation process produces relatively low amounts of energy, and there is also a loss of energy due to the increased excretion of microbial waste products. Therefore, the energy produced by the catabolism of tagatose is much lower than that of sucrose. If tagatose is used to replace sucrose in the diet, it can effectively reduce the incidence of obesity.
(2)血糖値の低下:研究では、タガトースを摂取した後の血糖値やインスリン値に有意な変化はないことが示されています。また、タガトースは小腸でのブドウ糖の吸収を抑制し、糖尿病患者のブドウ糖摂取による血糖値の上昇を抑える効果があり、2型糖尿病患者の補助療法にも使われている。
(3)腸内フローラを改善します。d-タガトースは腸内のある微生物叢によって選択的に発酵され、有益な細菌の増殖を促進する。それは良いプレバイオティクスです。また、d-タガトース発酵によって産生される有益な短鎖脂肪酸は、大腸がんを抑制し、腸内病原菌を抑制し、有益菌の増殖を促進させる効果がある[3]。したがって、d-タガトースは腸内フローラを改善し、腸内の健康を維持することができます。
(4) Anti-caries: D-tagatose is similar to polyols in protecting teeth。それは口の中で酸のレベルが低く、プラークのphを下げないので、それは効果的に虫歯とエナメル質の浸食の発生を防ぐことができます[4]。
2 D-Tagatose生
D-Tagatosecan be produced by bioconversion or chemical synthesis. Because chemical production of D-Tagatose is prone to the formation of impurities such as fructose, sorbitol and mannose, which require repeated crystallization to remove, this significantly reduces the yield of D-Tagatose. Therefore, bioconversion is being continuously researched as a better method.
生物学的には、主にl-アラビノースイソメラーゼを用いてd-ガラクトースからd-タガトースへの変換を触媒する。l-アラビノースイソメラーゼ(ec 5.3.1.4、l-アラビノースイソメラーゼ、l- ai)の自然な機能は、アルドースとケトースの相互変換の変換を触媒することである[5]。d-ガラクトースからd-タガトースへの変換を触媒することもあるが、d-ガラクトースに対する親和性はl-アラビノースに対する親和性よりも低い。
2.1 L-AI筋
l-aiの最適な反応条件は、ソースによって異なります。好中球細菌からのl-aiの最適な反応温度は、alicyclobacillus acidocaldarius、bacillus halodurans、escherichia coli、lactobacillus gayon-iiを含む30 - 50°cである。好熱性細菌からのl-aiの最適な反応温度は、geobacillus stearothermophilus、g . thermodenitrificans、thermoanaerobacter mathraniを含む60 ~ 80°cである。thermo - toga neapolitanaおよびt . maritimaを含む超好熱性細菌からのl-aiの最適な反応温度は85-90°cです。l- aiからd-タガトースへの変換速度は温度の上昇に伴って増加するため、それまでのl- ai源のほとんどは、bacillus stearothermophilusus100やthermoanaerobacter mathraniなどの好熱性細菌であった。しかし、これらの好熱性菌は食品グレードの微生物ではなく、食品の安全性に疑問があります。そのため、研究者たちは食品グレードの微生物を使ってd-タガトースを生産し始めている。
人間は何千年もの間、乳酸菌を使って様々な乳製品などの発酵食品を作ってきました。lactococcus lactisは現在、一般に安全と認められている最も優れた生物の1つであり、多くの異なるタンパク質生成物の効果的な発現宿主でもある。また、乳酸菌が増殖するphは、ラクトースが加水分解されるphと同じであるため、d-タガトースの生物学的変換に最適です。現在、l-タガトースを発現することが示されている乳酸菌の食品グレード株には、lactobacillus gayon-ii[6]、lactobacillus plantarum[7]、lactobacillus sakei 23 k[8]、および2011年に発見されたlactobacillus fermentumがあります[9]。(lactobacillus sakei 23 k)[8]およびlactobacillus fermentum[9]は、2011年に発見された食品グレードの株です。食品グレードの菌株を使用することで、微生物による酵素的なタガトース生産がより安全になる。
2. 2 l- aiの分子修飾
l-aiタンパク質を発現するaraa遺伝子は多くの種で同定されていますが、l-aiの工業生産にはまだ多くの問題があります。そのため、l- aiの分子修飾を行い、工業生産の要件を満たす酵素を得ることは、l- ai研究の重要な部分となっています。大腸菌のl-aiの結晶構造が決定されており、ガラクトースからタガトースへの異性化の原因分子を特定するための基礎となっている。rhimiら[10]は、g . stearoothermophilus us100の結晶構造と配列から、l-アラビノースイソメラーゼの必須触媒および基質認識部位を決定した。d-ガラクトースの変換速度を向上させるために、l-aiの分子修飾は主に基質特異性の向上、耐熱性の向上、最適phの低下に焦点を当てている[11]。
l-ai遺伝子の直接進化は、反応速度を向上させる最も有効な方法であると考えられた[12]。研究チームは、ポリメラーゼ連鎖反応により、g . stearothermophilusから変異体l-aiを得た。この酵素は、野生の酵素v322m、a393t、a408vと比較して、3つのアミノ酸部位変化を示した。このl-aiのバリアントは、d-ガラクトースへの触媒活性、最適温度、触媒効率、d-タガトースの収率を改善した[13]。王徳君の研究グループは、g . thermodenitrificansのl-aiを部位特異的に変異させた酵素(c450s-n475k)を作製した。g . thermodenitrificansのaiを部位特異的変異導入法で二重変異酵素c450s-n475kを得た。この二重変異酵素のd-タガトース収率は58%で、野生型酵素では46%であった[14]。
多くのl-aiの活性と熱安定性にはmn2 +やco2 +が必要であることが示されている。しかし、生体酵素法によるd-タガトースの製造では、高濃度の金属イオンを添加すると後処理コストが高くなります。そのため、金属イオンに依存しない熱安定性を持つl-aiの探索もl-ai分子修飾の主要な方向性となっている。現在、大腸菌のl- aiの立体構造が決定されており、その結晶構造と大腸菌のl-トレハロスイソメラーゼの結晶構造を比較することで、金属結合部位の可能性が推測されています[15]。
d-タガトースの工業生産には、l-aiが酸性phの範囲で反応する必要がある。d-タガトースはph 2から7で安定であるため、酸性条件下では褐変反応が減少する。なお、乳糖は生産を原材料としてが通常用い乳糖が必要加水分解先に半乳糖、酸性条件下乳糖分解通常が発生している(pH500 ~ 600)ため、D-tagatose生产は顺调に酸性L-AI変換使用することでpH調整の必要性を払拭し、コストダウンを図る。得られた耐酸性l- aiには、gsai (phopt 8.5)の部位特異的変異から得られた2つの変異体q408vとr408v (phopt 7.5)が含まれる[16]。現在では、val408 (gsai)やlys269 (aaai、bhaiのglu268、bsaiのgln268に対応)など、phoptに影響を与えるアミノ酸部位を決定することができます。将来的には、l-aiの結晶構造に基づいて、この2つの部位に変異が生じたり、phoptに影響を与える他のアミノ酸部位が発見されたりする可能性があります。
2. 3 l-aiの発現
現在、大腸菌はl-aiを生産するための宿主細胞として利用されることが多い。しかし、大腸菌におけるエンドトキシンの生産は安全性の問題を引き起こす可能性がある。そこで、工業生産や応用に適したl-ai遺伝子を得て、食品グレードの遺伝子組み換え細菌に発現させることが新たな研究課題となっています。xuらは[17]、大腸菌の代わりにラクトバチルス・fermentum cgmcc2921をl-aiの発現ベクターとして用い、l-aiの大規模発現を達成した。nooraら[18]は、l-ai遺伝子を乳酸菌lactococcus lactisに移植し、リン酸減少誘発性発現系でl-aiの発現を可能にした。
2. 4固定化生物触媒を用いたd-タガトースの生産
この酵素の機械的強度を向上させ、酵素活性の低下を抑えるためには、人工細菌を得た後に酵素または酵素産生細胞を固定化する必要がある。題して"おい研究グループがソウル大学し韓国は異なるシリカゲルの吸着、袋吊りなどの方法で固定化microencapsulation、アルギン酸ナトリウム埋め込み、glutaraldehyde大腸菌を捌い架橋L-AIおよび固定化の効果を比べる方法の換算率D-tagatose。その結果、アルギン酸ナトリウム-塩化カルシウム法を用いて固定化ビードを得た後、グルタルアルデヒドと架橋した酵素製剤が最も効果的であった。
遊離酵素、固定化酵素、固定化細胞のdタガトース産生能を比較したところ、同量の細胞では、固定化細胞のdタガトース産生能が最も高いことが明らかになりました。さらに、l-ai産生細胞を触媒として用いることにより、酵素の保護、変性の防止、反応バッチ数の増加、変換溶液中の不純物の低減が可能となる。fu fenggenらは[19]、固定化された組換え大腸菌細胞がd-タガトースを産生する能力を研究した。その結果、最適な反応条件下でdタガトースを基板として24時間使用すると、最高のdタガトース変換率65.8%、平均変換率60.6%を8バッチ連続で固定化し、dタガトース工業生産の基礎を築いた。
2.5 d-タガトースの収率に対するホウ酸の影響
反応温度を上げることに加えて、反応平衡をd-タガトースにシフトさせる別の方法は、反応混合物にホウ酸[b (oh)4-]を加えることである。ホウ酸は異なる糖と複合体を形成し、一般にアルドースよりもケトースに強い親和性を示す。この性質は、例えば、炭水化物のクロマトグラフィー分離におけるアルドースからのケトース生成を促進するために利用されている。ホウ酸塩はケトースとより強い複合体を形成し、例えば、d-ガラクトースよりもd-タガトース、l-アラビノースよりもl-リブロース、d-フルクトースよりもd-アルロースとより容易に結合する。変換を増加させることに加えて、ホウ酸緩衝液の存在は反応速度を増加させることもできる。
ホウ酸存在下でのd-タガトース、l-リブロース、d-アルロースの最大変換率はそれぞれ74、89、64%と報告されている。ケトースの製造工程にホウ酸を添加すると、元の化学平衡を破壊し、目標製品の収率を増加させることができる。変換溶液中のホウ酸は、特殊なホウ酸イオン交換カラム[20]を用いて糖-ホウ酸複合体から除去されます。nooraらによると[18]、thermotoga neapolitana由来のl-aiを60°c、ph 9.0でホウ酸を添加した場合、d-タガトースの収率は74%で、ホウ酸を添加しない対照群より24%高かった。fu fenggenらは、固定化された組換え大腸菌細胞によるd-タガトース産生に関する研究において、異性化反応系の収率に対するホウ酸の基質に対するモル比の影響を調べた[19]。その結果、適切な量のホウ酸を添加することで、元の化学平衡が変化し、d-タガトースの高収率が得られることが示された。
2. 6 d-タガトースの分離精製
Both the bioconversion and chemical conversion methods use D-galactose as the raw material, and the final reaction product is a mixture of D-tagatose and D-galactose. Therefore, the separation and purification of D-tagatose is also a factor affecting the yield of D-tagatose.
一般的に使用される分離方法は、カチオン交換クロマトグラフィーまたは単純樹脂分離です。huang wenxiaら[21]は、ca2 +イオン交換樹脂クロマトグラフィーと陰イオンと陽イオン交換樹脂の脱塩と脱色を用いて、d-タガトースを分離・精製した。d-tagatoseの回収率は83%に達し、純度は98に達した。分離の原理は、主に、異なる単糖とca2 +の複合化の程度の差に基づいて単糖を分離精製する。また、ビール酵母(saccharomyces cerevisiae l1)を用いてd-ガラクトースを選択的に分解することで、d-タガトースを精製することも報告されている。この方法で得られたd-タガトースの純度は95%以上に達する。未反応のd-ガラクトースを回収して再利用することはできないが、この方法は分離効率が高く、低コストで、操作が簡単であるという利点があり、d-タガトースの工業生産に選択肢が多い。
3. 申し込んだD-tagatose
3.1. アプリケーション食品
Because D-tagatose has physical properties and sweetness similar to sucrose, and also has physical and chemical properties such as 酸resistance, alkali resistance and heat resistance, it has broad application prospects in the food industry as a functional sweetener. It can be used in healthy drinks, yogurt, chocolate, chewing gum, foods for diabetics, diet foods, cereal foods, etc.
現在、飲料業界で一般的に使用されている主な甘味料は、シクラミン、アスパルテーム、サッカリン、アセスルフェーム、ステビアなどです。これらはすべて強い甘味料であり、金属性、苦味、渋みなどの望ましくない後味を生じやすい。しかし、タガトースを添加しても、後味が悪くなることはありません。また、d-タガトースはプロバイオティクスによって発酵・利用され、lactobacillus caseiやlactobacillus rhamnosusなどのプロバイオティクスの生育を促進する優れたプレバイオティクスである。

Studies have shown that D-tagatose can promote the growth of 乳酸菌casei and Lactobacillus rhamnosus, improve their beneficial activity and survival rate in the intestine. Therefore, D-tagatose can be used in probiotic supplements and also in yogurt, where it provides sweetness while increasing the number of live bacteria in the yogurt, enhancing its nutritional value and giving it a richer, fuller flavor. In 2001, the US Food and Drug Administration officially approved the use of D-tagatose as a sweetener in the food and beverage industry. In 2003, PepsiCo began using tagatose in Sprite drinks, and since then it has been widely used in the United States as a substitute for sucrose in healthy drinks, yogurt, fruit juice and other products.
dタガトースは低温でキャラメリゼーションを起こしやすいという特徴がある。研究によると、d-タガトースはアミノ酸とメイラード反応を起こし、グルコースやガラクトースなどの還元糖よりも、2-アセチルフラン、2-エチルピラジン、2-アセチルチアゾールなどの揮発性物質を生成する。[22]。理想的な色だけでなく、よりまろやかな風味を出すために焼き菓子に使用されています。タガトースはショ糖に比べて粘度が低く結晶化しやすいため、アイシングに利用してシリアル食品の表面に塗布すれば、製品の甘みを高め、保存性を高めることができる。
3. 2 医療、化粧品、その他の分野での用途
d-タガトースは2型糖尿病の治療薬として用いられる。研究では、d-タガトースは、体重を減らし、高密度リポタンパク質(hlp)の含有量を増やすことによって、2型糖尿病の症状を軽減することが示されています。咳止めシロップ、入れ歯接着剤、口腔消毒剤にも使用できます。d-タガトースは、安定剤および保湿剤として化粧品に使用されている。d-タガトースは、虫歯や口臭に効果があるので、歯磨き粉やうがい薬にも使えます。現在、多くの歯磨剤は湿潤剤としてd-ソルビトールまたはグリセリン、またはその両方を使用している。しかし、d-ソルビトールはスクロースの半分しか甘くないのに対し、d-タガトースはスクロースと同じくらい甘く、ソルビトールと同様の吸湿性を持つ。歯磨き粉やうがい薬にd-タガトースを添加すると、良好な濡れ性と安定性を維持しながら甘味を高め、味覚要件を満たすことができます。
参照
[1] レビン G VTagatose、 新しい 生まれて初めて sweetener and health 製品[j]。J 医学 ^パウサニアス、5巻23 - 36。
[2] ああ D K。 Tagatose: propertiea、 アプリケーション and biotechnologicalプロセス [J]。たら Microbiol ^アポロドーロス、2007年、76 - 76頁。
[3] mu wanmeng, zhang tao, jiang bo, et al。D -タガトースおよびl-アラビノースイソメラーゼの研究進捗状況[j]。^『食と発酵産業』2007年、33:84-90。
[4]黄 D 甘味料 determined safe in 薬、マウスウォッシュ、歯磨き粉 [J]。^ a b c d e f『週刊ファミ通』2000年11月号、32 - 34 - 35頁。
[5] liang min, zhai yafei, zou yang, et al。新甘味料「タガトース」の応用と製造[j]。^『食と薬』2011年、13:125-128頁。
[6] cheetham p s, wootton の N。Bioconversion D -半乳糖 に D- tagatose [J]。酵素 ^パウサニアス、3巻105 - 108。
【7】Chouaye k h ^ a b c d e f g h h hi M, et アル 特性化 of L arabinose 異性化酵素 から the Lactobacillus plantarum NC 8株 示す 発音 安定 at 酸性 pH [j]。 2007年FEMS Microbiol Lett277: 260 - 267町であった。
[8] Rhimi M, Ilhammami R, Bajic Get アル The acid 寛容 食品グレードのlactobacillus sakei 23 kからのlアラビノースイソメラーゼは魅力的である D-tagatose プロデューサー [j]。 Bioresour 2010年Technol、101:9171 - 9177。
[9] 徐 z清y J、李 S et アル の 小説 L-arabinose 異性化酵素 乳酸菌fermentum CGMCC2921 for D-tagatose 生産:遺伝子クローニング、精製、特性化 [J]。JMol ^ a b cアポロドーロス、2011年、1 - 7頁。
[10] rhimi m, juy m, aghajari n, et al。ものの探査 必須残留触媒 and the 基板 親和 in the thermoactive stearothermophilus菌 US100 L-arabinose 異性化酵素 by site-directed mutagenesis[j]。J 2007 Bacteriol、189:3556 - 3563。
[11] 金 P。現在 研究 l -アラビノースイソメラーゼを用いた生物学的タガトース産生について:a 審査 and 未来 観点 [j]。 ^ a b c d e f g h i l l biotechnol,2004,65, 243 - 249。
[12] 金 尹P S H ソ M J et アル 改善 of tagatose変換 rate by 遺伝子 進化 of thermostable 半乳糖異性化酵素 [J]。Biotechnol たら ^パウサニアス、9巻9・9・10。
[13]金 H J、金 J Hああ h j, et al。特性化 of a 変異Geobacillus stearothermophilus L-arabinose 異性化酵素 これはd-タガトースの生成速度を増加させる [J]。^ a b cアポロドーロス、2006年、21 - 21頁。
[14]あ~ H J、金 H j oh d K。d -タガトース生産量の増加 変異原の L-arabinose 異性化酵素 Geobacillusから thermodenitrificans [j]。 Biotechnol Lett ^『官報』第2814号、大正9年4月28日。
[15]あ~ D K。 属性:属性、属性、属性 biotechnologicalプロセス [J]。たら ^パウサニアス、2007年7月1日、1 - 8頁。
[16] ああ D k, oh h j, kim h j, et al。lアラビノースの最適phの変更 異性化酵素 から Geobacillus stearothermophilus for d -ガラクトースの異性化 [J]。J Mol Catal 2006年B-Enzym、43系統108 - 112について説明する。
[17]徐 Z、李 S甫 F et アル 生産 of D-tagatose、 機能性甘味料,アルギン酸immobilizedlactobacillus fermentumcgmcc2921cellsを利用 [j]。 たら バイオケミカル 2012年Biotechnol、166:973 961 -。
[18] 逃すな S Kalle のSマルティ L et アル D-Tagatose production in the
硼酸塩の存在 by 休んで Lactococcus lactis 細胞 こもるBifidobacterium longum L-arabinose 異性化酵素 [j]。 ^「bioprocess biosyst eng,2013,36:489 - 497」。bioprocess biosyst . 2013年4月29日閲覧。
[19] fu fenggen, xu zheng, li guixiang, et al。固定化された組換え大腸菌細胞を用いたd-タガトースの生産[j]。中国バイオエンジニアリング誌,2011,31:85-90。
[20] hicks k b, simpson G Lていた。レイ・ブラッドベリ A G。 除去 of すべてホウ 酸や 関連 化合物 から 解決策 of carbohy -drates ボロン-選択的に レジン(ira - 743) [j]。 Carbohydr ^ a b c d e f g h i 1986, pp . 39 - 48。
[21] 黄文霞、穆完孟、江伯。d-タガトースの分離精製[j]。^ a b c d e f g h i『食品と発酵産業』、2008年、34:168-171頁。
[22] In H D、サラ L, Hae-Roung J et アル 比較 of 揮発性メイラード 反応 製品 から Tagatose and 他 還元糖 with 網野 酸 [j]。 Food なければならない。 ^パウサニアス、2010年1月19日、41 - 41頁。


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本




