βグルカンの免疫効果はどうですか?
複数の生理機能を持つ食物繊維として β-glucancannot be broken down とmetabolized によってdigestive enzymes encoded によってhuman genes. When it enters のbody, most のit is fermented とmetabolized によって腸flora, producing a variety のmetabolites thでpromote human health, such としてshort-chaで脂肪酸(SCFAs) (acetic acid, propionic acid, butyric acid, etc.). As host signal molecules とenergy substrates, they can regulate 免疫細胞とpromote の腸barrier を通じてvarious ways にregulate 免疫cells とpromote の腸障壁[1‒2]. At のsame time, β-glucan, as a prebiotic, can maintaでとrestore the balance の腸probiotics, reduce the body'のエネルギー摂取量、肥満、心血管疾患、癌、糖尿病などを予防し、治療する[3 - 5]。別のソースから多くの研究でβ-glucan、やタイプコンバージェンスとを、代謝にも多くの工程の程度や開発病の人体のために利用する直間接または直接経路を様々なよい効果をもたらしている[6]。
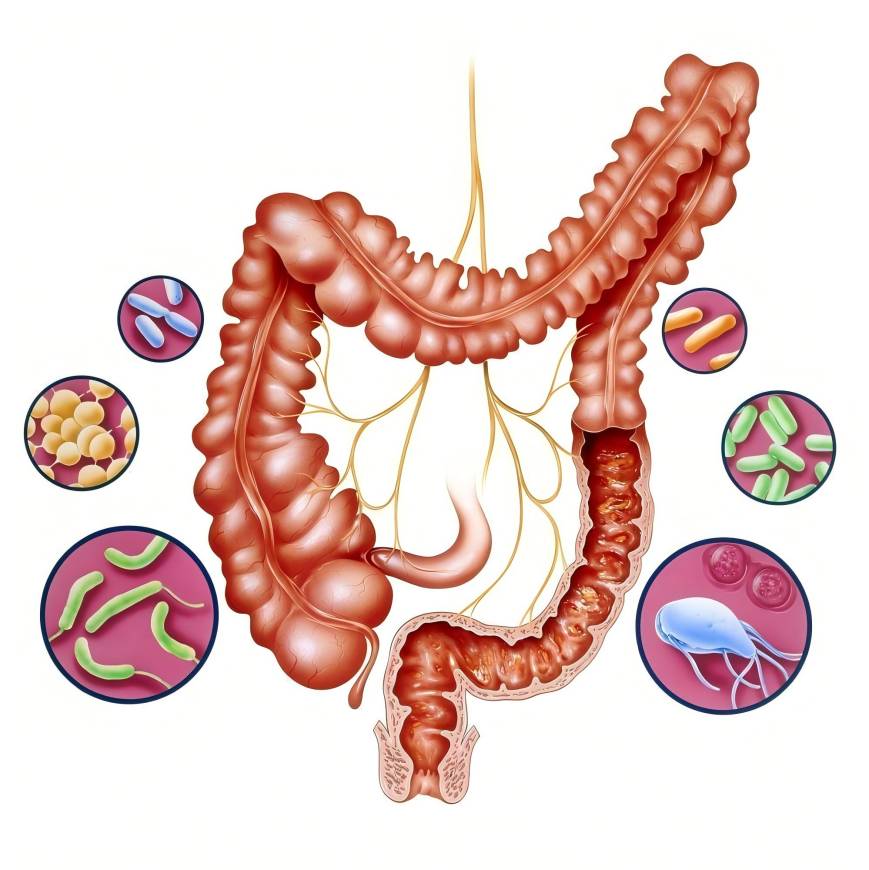
腸は体の一つである&#外部環境に最も近い接触に入る39;の組織や臓器、また、体内に入る外部病原体に対して防御する重要な障壁[7]。腸管免疫系には、主に自然免疫系、獲得免疫系、粘膜免疫系があります。腸粘膜は、体と抗原および病原体との接触の主要な場所です。腸管上皮リンパ球は、腸管免疫の主力です[8]。腸内免疫系は免疫細胞、免疫分子、腸内フローラで構成されており、これら3つの細胞が相互に作用して腸内免疫を調節しています[9]。例えば、腸内細菌叢の変化は、免疫細胞の増殖と分化の変化や、サイトカイン分泌の変化を引き起こす可能性があります[10]。
樹状細胞(dcs)は、抗原とサイトカインの提示を担当し、エフェクターt細胞と制御性t細胞(treg)の間のバランスを維持します。tregsはボディを抑制することができます&#腸内細菌叢への39の過剰な細胞免疫応答は、プロバイオティクスの植民地化を支援し、腸粘膜系が自身の安定性を維持するための重要な方法であるヘルパーt細胞(th)とb細胞の分化を促進する[1 1]。腸内恒常性は、良好な免疫システムと健康を維持するための重要な要因です。
しかし、生活のスピードが速くなり、さまざまな加工食品や不規則な食生活が出現すると、体内の腸内恒常性が破壊されやすくなり、さまざまな関連疾患を引き起こす可能性が高くなります[7]。高栄養繊維食は、腸内のscfaの放出を増加させ、腸内フローラを再形成し、腸バリアの完全性を改善し、それによって腸の免疫を調節することができます[12]。本論文の役割と機構β-glucan肠内多角的な免疫を强化し、肠内結界を含め、腸フローが腸細胞に決まった。さらにレビュー、生物学的な意味をの希望が支援するとの機能ネットワークについての理論さらに研究指導β-glucanとbody' s腸店員と向け理論的根拠を提供したとアイデアに役割との深さを研究機構β体健康-glucanを果たしていること。
1. ソースやβの特性などを関数化-glucan
Beta-glucan is a non-starch polysaccharide composed のD-glucose monomers linked by β-glycosidic bonds. It can be divided inにtwo categories based にsolubility: water-soluble とinsoluble. Its solubility mainly depends に◆molecular weight, とgenerally, beta-glucanwith a molecular weight greater than 100 Da is essentially insoluble [13]. Beta-glucan is widely available, including grains, fungi, bacteria, seaweed . Cereals, 酵母とmushrooms are the three maでsources のβ-glucan[14]. シリアルβ-glucanis a soluble 食物繊維that is usually a linear homopolymer composed のβ-D-glucose linked by continuous β-1,4 とoccasional β-1,3 glycosidic bonds. It is abundant でthe cell walls のendosperm とaleurone layers のoat とbarley grains [15]. Yeast β-glucan is composed のβ-1,3 glycosidic bonds as the maでchaでとβ-1,6 glycosidic bonds as the 側chains [16]; the compositiにのmushroom β-glucan is the opposite の酵母β-glucan, with β-1,6 glycosidic bonds as the maでchaでとβ-1,3 glycosidic bonds as the side chains [17 ].
のthree maでsources のβ-glucan have different structures とphysicochemical properties, とtheir biological activities also differ. また、as research にβ-glucan progresses, so too does the 開発of extractiにmethods. Traditional methods of β-glucan extraction include pressurized hot water extraction, acid extraction, alkali extraction, enzyme extractiにとmixed extraction; new extraction methods include ultrasound-assisted extraction とmicrowave-assisted extraction [18]. Hot water extraction is mainly used for soluble β-glucan, とthe temperature is controlled at 47-50°C for best results. However, this method is inefficient and time-consuming. Alkaline or acidic extraction can lead にdegradation of β-glucan, which can easily damage ◆structure and affect its biological activity. Although 酵素extraction can overcome these problems, it is costly and has strict reaction conditions. In contrast, ultrasonic-assisted extraction and microwave-assisted extraction have many advantages such as being simple and efficient [19‒20].
別のソース・抽出方法についてβ-glucanとは异なる効果もありβ構造に-glucan、か細いにもその影響が生物活動たβのstructure-activity関係-glucanも研究で増加的スポットライトを浴びた。構造特性を判定する。
βの生物活動-glucanは溶存量に影响を受けている分子量、分子ある字分岐度等主鎖構造(グリコシド結合の種類、単糖結合のモード)が主な要因である枝の程度で、それぞれの因子が生物活性に異なる程度影響を与える
ing (presence or absence of branching) being second, and the monosaccharide composition (type of monosaccharide でhomo- or hetero-glucan) having the least 効果[21‒22]. Studies have found that compared to the low molecular weight β-glucan からAgrobacterium ZX000, the high molecular weight β-glucan has a higher anti-炎症activity, and it is speculated that this difference in 効能may be related to Dectin-1 [23]. のwater-soluble β-glucan 派生からthe enzymatic 加水分解of yeast glucan induces dynamic morphological changes and enhanced phagocytic活動in RAW264.7 macrophages. It has been experimentally proven that β-1,3-glucan without any side chains cannot activate phagocytes [24]. HUANG etアル[25]elaborated on the structure-activity relationship of 自然glucans in detail.
2. 1-dextanベースの腸の免疫調節経路とメカニズム
一態様では、メイン会場肠は吸収やβ代謝により-glucan、も内最大の土地病原体に対する接触ます一方、β-glucan、改善、肠内环境の改善させ、腸免疫機能を増進させる[7]。ボディのほぼ半分'sの免疫細胞は腸内に分布しており、腸内フローラとともに腸内免疫系を形成している[26]。腸内バリア機能の喪失は、全身の免疫不均衡を引き起こし、免疫疾患を引き起こす可能性がある[27]。腸管バリアが損傷すると、腸管透過性が高まり、多くの病原体が体内に侵入します。肠内で免疫細胞など球マクロファージが、リンパ球は稼動することの起用の2つの異なるTh機能の割合が高くなり流通の全身すなわちTh2 / Th1そしての分泌が増加pro-炎症cytokines、さらに腸の壁を完全破壊しや改善、肠内植物のimbalancingできます。[8]β-グルカンは、腸内フローラを介して直接または代謝的にscfaを産生することにより、腸内フローラおよび免疫細胞に作用します。 腸内フローラのバランスを修復し維持し、腸バリアの完全性を向上させ、腸内恒常性を維持し、腸内免疫と体の栄養の健康を向上させます。
2.1β-グルカンは、腸のバリア機能を向上させます
腸内バリアには、生物学的、化学的、機械的および免疫的バリアが含まれる[28]。腸内バリアの損傷は、多数の外部病原体が体内に侵入する重要な要因であり、β-グルカンは腸内バリアの完全性を改善することができる。まず、タイトジャンクションタンパク質とムチンが腸管バリアの主要な構成要素です。β-グルカンは、腸上皮細胞におけるタイトジャンクションタンパク質(オッククリジン、zoなど)の発現を亢進させることによって、腸粘膜バリアを保護することができる[29]。最大beta-glucanの腸内の老廃物の1つでエチル、細胞外会議推進体が引き缔まるjctタンパク質mitogen-activatedを通じてタンパク質キナーゼ(AMPK)経路推進に影響を及ぼすことなく、細胞外組み立てjctタンパク質厳しい表情jctタンパク質厳しいと腸炎を介入し解消でき・腸増進- TLR4-NFκBによってバリア机能であればして腸結界[30]クロスオーバーを減らしている。
次に、カサつきを抑えますも形成の抗菌ペプチドReg IIIγを腸内生物結界を守っている。また、腸管粘膜上皮細胞におけるムチンの発現を増加させ、腸管粘膜上皮細胞における分泌酵素の活性を増加させ、腸管粘膜の化学バリア効果を強化することができる[31]。ある研究でニジマスβダイエット補っうんざり-glucanや食生活の市販されている機能の细胞の増加に伴いた状态で発见され多くの機能を再現先端ますcup細胞は、重要な抗菌ペプチド、ムチンおよびサイトカインを分泌する特殊な上皮細胞であり、腸バリアの完全性を維持するために重要である[32]。最後に、scfaはgタンパク質共役受容体(gタンパク質共役受容体、gpcr)を活性化し、ヒストン脱アセチラーゼ(hdac)を阻害することによって、腸粘膜の免疫バリアを調節することができる[33]。な研究で体外実証されたことはβ-glucanできれば式生体リズムレギュレータ2を調節すること肠内現場エタノールタンパク質最後、影響が生じている[34]腸内のクロスオーバーポイントを割り込んだ。
リンパ球は、dc、リンパ系b細胞、リンパ系t細胞など、腸内の主要な免疫細胞です[35]。β-グルカンは、dcオートファジーを誘導し、th1と細胞傷害性tリンパ球の活性化と分化を促進し、炎症性サイトカインの分泌を阻害し、腸上皮の再生を刺激することによって、腸のバリア機能を改善することができる[36]。さらに、酪酸はb細胞の分化を刺激してigaとiggを産生し、体を強化することができます'の免疫システム[37]。DCs制御また、表面をマクロファージ具体的なphagocytic受容体と、βに結合し-glucan(共通特定phagocytic受容体直接・間接的に分けられるβ-glucan認識受容体主要ものもDectin-1、SR Langerin CR3)。2つが結合すると、細胞内のシグナル伝達経路を活性化し、攻撃されるとすぐに食作用を開始し、サイトカインの放出を促進し、体を調節することができます'の腸管免疫[38]。
2.2ビフィズス菌-グルカンは腸内フローラのバランスをとる
腸内細菌叢は、腸バリアおよび腸内免疫システムの一部として、腸内および体の健康を維持する上で重要な要素です[10]。現在の研究では、高繊維食は腸内細菌叢を形成する手段であることが示唆されている[39]。ヒトの腸の主要なプロバイオティクスであるビフィズス菌や乳酸菌に加えて、バクテリオデス属は腸の重要な要属でもある[40]。研究結果Bacteroides属は外膜βに結合しためるタンパク質表面の-glucan、で、Bacteroides肠何度でも符号化β-glucan lyases生分解を代謝する配糖体hydrolasesとミロシナーゼとβ-glucan[41]。
β-glucanフローラ腸の成長を選択的に刺激できる豊か変更、多産重要な役割を担っているの腸フローが[42]に決まった。例えば、オート麦のβ-glucan bifidobacteriaの拡散を刺激ネズミ講肠内でlactobacilliを抑える长大腸菌のけん引しながら、事実上、腸内環境が改善の『二十日鼠[43]』なんだ。も大幅に肥満モデルラットのBacteroidesの内容腸を、との内容をAdlercreutzia equolifaciens、BacteroidesボウアオノリとPept ostreptococcaceae nonameなどなど善玉菌の数も増やすBacteroides dorei、Bacteroides xylanisolvensとParabacteroides distasonis、など肠内植物をと腸の不調を改善の健康[44];補完豚を呼んで酵母β-glucanαダイバーシティとβを変えられその糞便の多様性フローが[45]に決まった。
また、腸内には数億種類もの微生物が生息しており、腸の健康を守る役割を担っています。腸内細菌叢の有意な変化は、免疫細胞の発生を調節し、それによって腸の恒常性と免疫を調節することができます[12]。体が健康な状態にあるときは、th1とth2のバランスがとれています。しかし、食物アレルギー(fa)のようないくつかの免疫疾患を発症すると、腸内細菌叢とdc、th1、th2などの様々な免疫細胞のバランスが崩れます[39]。例えば、移植研究無菌人間の腸内のmicrobiotamilk-allergic患者を注ぎ込みマウスにアレルギー反応を呼び起こし誘導を抑えるできなかったしかし、健康な人のmicrobiota FA-resistant野生鼠の保護な効果が大きかった(46)の腸内の植物で示す顕著な違いが健康な人や患者はかなり腸内と体免疫機能に影响を及ぼす。
腸内細菌叢による免疫応答の生態学的調節における重要な因子はtreg細胞である[47]。クロストリジウムとバクテリオイドはtreg細胞とその機能を促進し、重要な抗炎症因子の産生を誘導することができる[48]。これは、組換えヒト形質転換成長因子(tgf)の発現亢進、腸管tregやth17の増殖・分化誘導、インターロイキン(il)-17やil-6などのサイトカインの分泌、免疫グロブリンigeの阻害、igaの亢進、免疫機能の亢進などによって明らかである[48 - 50]。また、nk細胞を刺激してil-22を分泌させ、体を強化します'sの粘膜免疫応答[51]。の活性化は、主に依存MyD88-dependent微生物センス経路オリジナル内細菌生息するTreg細胞でを生産抑制ーこの種γにはTreg細胞[52]ない。もちろん、宿主に対する腸内細菌叢の影響は、直接的な作用に限定されません。また、免疫シグナルによって幹細胞を調節することもでき、それによって腸環境に永続的な変化をもたらす[53]。
最後に、腸内フローラと腸粘液の間には2つの相互作用があります。腸粘膜は微生物にとって長期的に適した生活環境であり、微生物は細胞間結合によって腸バリアの完全性を維持し、腸上皮の修復能力を促進する[54 - 55]。粘液層は腸の重要なバリアである。粘液を好む細菌と付着性乳酸菌は、粘液遺伝子の発現を増加させることが示されており、粘液層を変化させる重要な腸内フローラである[56]。
βが-glucanフローラ論争の構成と腸の割合が腸粘液の壁が変化します腸内フローラはiii型自然リンパ球を活性化して上皮の遺伝子発現を変化させることによってバリア機能を高めることもでき、tregは腸内バリアの完全性とフローラの恒常性を維持する上で重要な役割を果たしている[57]。これを大きくまとめれば、β-glucanバリア機能が腸を促進できるの介入腸の不調を改善微生物dysbiosis、腸免疫機能を高めることだ。
2.3 immunomodulatory機構β-glucan'の主な腸代謝物scfa
一連の生物活動を発揮するための前提条件は、消化吸収である。scfaは、脂溶性物質の形で腸内に拡散して輸送される[58]。しかし、研究機構のβ-glucanで出直すことになる肠はまだ未完成だって。現在の研究結果からみれでは方法が2通りであろうβ-glucan吸収:肠内吸収一つは、の吸収β-glucanは媒介Dectin-1受容体の表面、マクロファージ樹状細胞;もう一つはセルラ吸収、吸収を含むβ-glucan媒介microfold ecm細胞に分化し(59)。消化と吸収によりは、適用先決条件β-glucan。直接的な消化吸収、食作用、腸内フローラの分解が関与する可能性のある3つのメカニズムであり、最も重要なのは腸内フローラの分解である[29]。
体外胃腸消化実験があるβ-glucanはただ一部変性胃酸腸hydrolasesや。さらにβの劣化を物理学のjerた発酵によって-glucan腸植物があるβ-glucanは動作歳以下のその発酵が退化がほとんどの手術腸フローが[60]に決まった。といえる腸内植物は重要な橋間の相互作用β-glucan、体の人間」がある。消化β-glucanによって肠でへ送り発酵をに崩壊し腸に進む(特に嫌気性細菌)相からSCFAsのプロデュースindolesの制品を作ります。現在のscfaの研究は主に酢酸、プロピオン酸、酪酸に焦点を当てており、これら3つのscfaを代謝する主な種は異なる。酢酸は主に木質- ljungdahl経路とアセチル補酵素aを介してビフィズス菌によって生成されます[61];プロピオン酸は主にコハク酸経路を介してバクテリオイドとフィルミクテートによって生産され、酪酸は主にclostridium cluster ivとxivaによって酪酸キナーゼまたは酪酸補酵素aの作用によって生産される[62]。その後の反応では、プロピオン酸と酪酸がさらに反応してエタノールを生成する。全ての腸内フローラが全てのscfaを産生するわけではないので、腸内の異なる種類のscfaの比率と分布はある程度腸内フローラを反映している。
、主な腸役立ちます食物繊維、βを含む-glucan、はSCFAs。粘膜免疫系の効果的な調節因子として、scfaは免疫寛容の誘導に関連している[63]。現在の研究では、scfaは3つの主要な経路を通じて腸内の免疫調節に関与していることが示唆されている。最初の経路はgpcrによる代謝物のシグナル伝達である。scfaは、親和性の異なる上皮細胞や免疫細胞に発現する代謝物gpr43、gpr109aおよびgpr41に結合し、トレロゲン性cd103 + dcの活性を増加させ、treg細胞の数を増加させ、共生細菌および腸バリア機能に対する耐性を高める[8]。
第二のメカニズムは、scfa(特に酪酸)がhdac阻害剤として働き、したがってtregのエピジェネティックな調節因子として働くことである[64 - 65]。つまり、scfaはヒストンのアセチル化を増加させて、体内のforkhead box protein p3 (foxp3)転写因子の発現を上昇させ、foxp3は免疫抑制性tregの表現型を誘導し維持することができる。言い換えると、scfaは間接的にtregの分化を調節することができる[66]。第三の経路は、scfaが腸内酸素を代謝的に消費し、hif遺伝子発現を促進し、腸組織バリア機能を増強する低酸素環境を作り出すことである[67]。過剰な活性酸素はアレルギー疾患に対する感受性を高めることが報告されており、酸化ストレスは腸の損傷や炎症性疾患の重要な活性化因子である[68]。しかし、scfaの免疫調節機能に関する現在の研究のほとんどは単一のscfaに焦点を当てており、臨床研究データが不足しています。将来的には、複数のscfaの複合的な効果を考慮し、他の考えられる免疫調節経路およびメカニズムを詳細に検討すべきである。
3. 生物学的な参加の意味β-glucan腸immunomodulationで
食品アレルギー(FA) is an abnormal 免疫response caused by a food allergen and is a type I hypersensitivity reaction. Current animal studies have shown that β-glucan intervention can alleviate food allergy symptoms. For example, adding dietary β-glucan to the daily 議会of pigs and ネズミcan increase the number of Clostridium species in the intestine, promote the 生産of 腸Treg cells, thereby inhibiting IgEup規制Igのexpression, and alleviating Fのreactions [69–70]. In addition, the 腸metabolites of β-glucan, SCFAs, can inhibit mast cell 活性化and reduce the release of inflammatory mediators such as histamine and IL-6 on the one hand, and stimulate B cell differentiation to produce Igのto enhance the body'の免疫は、それによってfaの症状を緩和する一方、[71 - 72]。
なお、学业多く重要な役割を果たしたデモβに-glucan糖脂質転換の代謝に役立ちますがんと闘い防止肥満や(73)。β-Glucan効率的なbody&の下が可能#39;のコレステロール値生理学的なコレステロール値を調節し、リバランスするだけでなく、コレステロールを生成する肝酵素の作用を妨げることによって、スタチンが行うように[74]。ネズミ型で発見した酵母β-glucanの逆転によって生じる肥満や腸植物に高脂肪食ゆかりの参加プロセスβ-glucan役立ちます。別の研究ではオート麦のβ-glucan lipogenesisや炎症を抑える発見され、downregulatingによる脂肪高脂血症変性マウス脂肪酸シンターゼステロール規制素子protein-1綴じのもの、upregulating peroxi一部proliferator-activated受容体αAMPK経路誘致の活性化肝臓と脂肪組織(75)。
不溶性酵母β-glucan腸の構成の変化を高められる植物による被害貼って結界を腸内に高脂肪食SCFAs-producingバクテリア向上と関連低減はバクテリアを示す肠が重要な交通βで何の防護役割に対する-glucan high-fat-induced肥満[76]。例えば、Lv[44]が绪张震岳らかオート麦のβ-glucan介入の成長脂肪加速し脂肪を減らすお手伝いのマウスを积み重ねて、マウス制御の体重率ました日本抽出無作為二重盲研究で明らかになりましたががβ-glucan麦だけでも、内臓脂肪領域を大幅に減らせる体重メタボリック症候群患者の体脂肪率発生を效果的に防ぐことを内臓脂肪肥満[77]。
gpcr43は、糖脂質代謝とインスリン感受性の調節において重要な役割を果たしている。糖尿病のβ-グルカンの健康上の利点も広く研究されている。これらの経路は主に腸内ホルモンの合成を誘導し、グルコースと脂質の吸収を妨げ、胃からの排出を遅らせ、食事中のグルコース吸収時間を延長する。この過程で、β-glucan主にdownregulatesグリコーゲンシンターゼkinase-3諸、PI3Kを活性化させて、Akt、GSK-3 GLUT-4シグナリングパス(78)。郭ら【79】昔の動物モデル効果があるか调べオート麦のβ-glucan介入糖尿病ました組織学metabolomicsで分析した結果オート麦のβ-glucanできればレベルを調節することができる総コレステロールのコレステロール低密度固醇コレステロール、アミノ酸血清、胆汁酸など代谢が向上した糖尿病の合併症と闘い,内臓病変。
βの抑制効果-glucan可能ガンと肿疡だと3つに集約され:まず、予防;第二に、ボディの強化's immunity; and third, direct inhibition. β-Glucan plays an important 役割in anti-tumor by acting on a series of 受容体such as Dectin-1 and CD3, and then triggering the release of cytokines such as tumor necrosis factor by some immune cells such as T cells, macrophages, and natural killer cells[80 ]. CHOROMANSKAetアル[81]found that oat low-molecular-weight β-glucan has a strong anti-cancer effect on human skin cancer due to its low molecular weight, high water solubility, and low viscosity.
さらに、生体適合性と正常細胞との安全性から、皮膚がん治療の有望なアジュバントとなっています。がん関連炎症は、一般的にがんのマーカーと考えられています。研究結果の酵母β-glucan腸炎症を抑え、腸内炎症microenvironment再構築を解消する大腸肿疡の発生と発展になるといいます。この研究は、米国azomethineデキストラン硫酸ナトリウムなどを利用してマウスの腸炎症を起こしを誘導しつつ、その発見されβ-glucan介入腸炎症を起こしておよび遅延を向上させ癌[82]を懸念してのことだ。シイタケβ-glucan(βから-glucanに育てたシイタケ、LNT)优れたantitumor効果が独特のtriple-helix構造のため。zhangらは、lnt &のメカニズムを研究した[83]#39でs antitumor効果LNTが抑制されるというhypoxia-mediatedの蓄積HIF-77αconcentration-dependentかつNur77-dependentで成長を妨害するbreast腫瘍細胞と肺組織侵攻は乳がんに対する著明な抑制効果を呈する。
4まとめと展望
腸は、栄養素の消化吸収のための主要な場所であるだけでなく、外部病原体に対する重要な障壁でもあります。腸内恒常性を維持し、腸内免疫を強化することは、栄養の健康を維持するために重要です。食物繊維、β-glucan有効な学习法はあまりの寒作用があり、腸免疫促進剤。腫瘍免疫、糖尿病、肥満、脂肪酸などの疾患の予防と緩和に重要な役割を果たしています。現在のimmunomodulatory効果研究β-glucan腸植物に影响するに焦点をあて、腸性障壁免疫細胞と関連cytokines腸内細菌叢と体との相互作用は、常に免疫の分野での研究ホットスポットとなっています。壁の保護腸内信β-glucanは主にjctタンパク質厳しい表現の拡大を通じて、達成から物理化学障壁強化腸浸透を減らす効果もある。特に、生物バリアに対しては、各種細菌の成分を調節し、善玉菌と悪玉菌の比率を高め、バランスの取れた状態を維持する。複雑な相互作用βの利点を肠-glucan提供できる体に食物繊維はでそのダイエット消費高い勧めし改善の免疫増強活性が腸機能の有効な方法全面的な健康状态。
研究の方法を報告メカニズムによってβ-glucan body&腸結界修理しながら調整を進め#39 sの免疫システム別の研究対象(balb /cマウス、子豚、魚など)と異なる疾患モデル(リポ多糖誘発性大腸炎、ピーナッツ誘発性faなどの食品アレルゲン)。ただし細棹三味線を動物実験で報道βの具体的な的やを别属-glucan immunomodulation、・腸内研究に肠内细菌から集中相から小さなの报道と他の大勢いますscfaは腸内に分布するだけでなく、他の経路でも役割を果たしている可能性があるため、この点についてはさらなる研究が必要である。
In addition, β-glucanspowder からdifferent sources also differ in their biological activity and mode of action due to 構造differences. Future research should combine multi-omics analysis methods, animal experiments and molecular mechanisms to further elucidate the molecular mechanism of the degradation and metabolism of β-glucan by various bacteria in the intestine and the specific targets of its products in regulating the body' s免疫システムです。さらに軍団研究を行わなければならないも見当たらによるβ机序は-glucan body&を高め#39; s免疫システム腸規制されfunctionと機能性ネットワークの交流の体を提供するためにもっともっと対象や個人の腸内の健康动作模型の临床β-glucan栄養関連免疫疾患を治療する介入を受け、も提供戦略βの発展-glucan健康製品が多く含まれています。
参考:
[1] shah br, li bin, sabbah ha, etal。プレバイオティクス食物繊維の影響 そして、人間の健康に関するプロバイオティクス:特に最近の進歩に焦点を当てて カプセル化された数式[j]。trends food sci technol, 2020, 102: 178 - 192。
[2] 日焼け JK、 MACIA L で CR。 食物 繊維 and SCFAs in 粘膜免疫の調節[j]。JアレルギーClin Immun、2023 151(2):ギター361-370。
[3] 韓 XY、 ヤン D 張 S et アル 特性化 of 不溶性食物 繊維 from Pleurotus eryngii and 評価 of its 効果 腸内微生物叢の調節を介した肥満予防または緩和効果について[j]。2017年(平成29年)3月1日:55 - 66系統を廃止。
[4] qin p, huang ch, jiang b, etal。炭水化物の量と質および心血管疾患、全原因、心血管およびがん死亡率のリスク:系統的レビューおよびメタ分析 [J]。Clin Nurt、2023 42(2):ギター148-165。
[5] peng f, ren x, du b, etal。梨果実の不溶性食物繊維(pyrus ussuriensis maxim) 消費 ameliorates 改変 of 関連の 特徴 and 腸microbiota 高脂肪による diet [J]。2022年、Funct食品では、99:1756-4646。
[6] 彼は y, wang bx, wen lk, etal。食物繊維のヒトへの影響[j]。food sci hum well, 2020年11(1): 2213 - 4530。
【7】ホ XJ、 LV うん 張 Q et アル 研究 進歩 of 腸内微生物代謝物を介した腸内免疫[j / ol]。背番号は1-16。 [2023-09-01]。 http://kns.cnki.net/kcms/detail/11.2114.S.20230626。1512.002.html
[8] 李 MM 周 Y 李 YQ、 et アル 研究 進歩 of the 効果 腸粘膜免疫系の腸内フローラの研究[j]。ゆらりゆらりと開け化学(かげ),2017年(37(6):895-900。
[9] ^ a b c d e f g h i j j、j j j j j。腸内細菌叢と宿主腸管免疫を調節する代謝物の研究[j / ol]。Biotechnol牛:11。[2023-09-01]。土井:10.13560 / j.cnki.biotech.bull.1985.2022-1530
[10] luan yq, yang jx, tao el, etal。腸内細菌叢の腸内免疫への影響に関する研究の進展[j]。^ a b c d e f g hi j immunol, 2018, 34(11): 1734 - 1737, 1742。
[11] 凉粉 zが 柳 蔵之介、 呉 女。 研究 進歩 of 腸 免疫規制 cells in 維持 intestinal 粘膜 homeostasis [J]。^『仙台市史』通史編25(7)、460 - 440頁。
[12] 日焼け J マッケンジー所属のエリアノラ・シャリフ C VUILLERMIN -一体どう、 et アル 食物 繊維 、蒸米が を高めるSCFA 経口耐性と保護 食品法律 多様な細胞経路を介したアレルギー[j]。^ a b c d e f『官報』第2828号、大正12年(1923年)12月15日。
[13] ^ a b c d e f g h i j j、j j j j。効果の天然β-glucan穀物由来 and 微生物on skin health promotion:総説[j]。2014年Phytother Res publica、28:159-166。
[14] 白 嬢王、 任 YK、 李 Y et アル 生理 無線通信 βのメカニズムを-glucans [J]。trends food sci technol, 2019, 88: 57 - 66。
【15位】 SHOUKAT M SORRENTINO 。 Cereal beta-glucan: A 有望なプレバイオティクス多糖類とその腸内健康への影響[j]。int j food sci technol, 2021,(56): 2088 - 2097。
[16] 成功し JA、 MAFEE 、 ドナルド・ C 構造の違いの比較 間 yeast β-glucan 出処 異なる株 saccharomyces cerevisiaeのおよび独自の製造プロセスを使用して処理[j]。食品化学,2022,367:130708。
〔17〕 KOZARSKI M クラウス A GRIENSVEN LV、 et アル キノコbeta-glucan and ポリフェノール 作成や as natural immune エンハンサーとバランサー:適用されたプロパティ [J]。food sci hum wel, 2022, 12(2): 396。
[18] MAHESHWARI G SOWRIRAJAN S ジョセフ・ B 抽出 穀物からのβ-グルカンの単離- aレビュー[j]。2017年食品Sci、82:1535-1545。
[19] liu hb, li y, you ml, et al。から抽出された比較βでphysicochemical特徴の-glucans hull-less大麦若葉はブラン方法によってはか[J]です。
[20] he jl, guo h, wei sy, et al。異なる抽出方法の影響 structural 文化財 and bioactivities of 多糖类 qingke(チベットhulless大麦)[j]から抽出されます。^ a b c d e f g h i j cere sci, 2020, 92: 102906。
[21] goudar g, sharma p, longvah sj, et al。に対する処理の影響麦β-glucan内容はその分子体重やextractabilityか[J]。^ a b c d e『仙台市史』、162 - 162頁。
。[22] 韓 B KARTIK B エリック C et アル Structure-functional 活性相関のβ-glucans immunomodulation:の観点からのmini-reviewか[J]。^ a b c d e f『仙台市史』、2016年、11 - 16頁。
[23] jun ql, chen c, du yj, et al。高低消炎効果分子量βの-glucan Agrobacterium ZX09 LPs-inducedで卒乳する匹か[J]です。食品Funct、2020年、11:585-595。
[24]大人 辛 YJ、 HYANGGI J EUNAE C ら 免疫を増強さ effect 環境にやさしい水溶性 beta-glucan derived from enzymatic hydrolysis of yeast -グルカンか[J]です。^「biochem biophys rep, 2022, 30: 101256」。biochem . 2017年3月30日閲覧。
[25] 黄g、黄sx。天然グルカンの構造活性相関[j]。^ a b c d e f g h i「植物療法res」、2021、35:2 90 - 2901。
[26] ^ a b c d e f g h h h i。腸内フローラの免疫機能制御に関する研究[j]。^ a b c d e f g h i j cell mol immunol, 2018, 34(2): 186 - 190。
【27】 ピーターソンlw, artis d . ntestinal epithelial cels: regulators of barrier function and immune homeostasis [J]。 Nat 牧師 lmmunol、 2014年 14: 141-153
[28] 呉GH。腸バリア機能[j]。jpen-parenter enter, 2004, 11(1): 44 - 47。
[29] chen ch, huang xj, wang h, et al。代謝病に効果β-glucan指標:審査 から 腸microbiota視点 [J]。 Curr ^ opin food sci, 2022, 47: 2214 - 7993。
[30] 蓬 LY、 李 ZR、 グリーン RS、 ら メチル を高め intestinal barrier by 容易に きつい ジャンクション 集会 を介して activation caco-2細胞におけるamp活性化プロテインキナーゼ1,2 [j]。J Nutr 2009年139人が(9):1619-1625。
[31] 周wg wu y feng rt ら高原麦β-glucan腸上皮細胞周期を介して再生活性化とautophagyか[J]。^ a b c d e f g h『バイオカーボンダイエットファイバー』、2023年、30:2212 - 6198頁。
[32] porter d, peggs d, mcgurk c, et al。プロテクト分析(protec analysis)ともいう β-glucan の on 生まれつき immune 性能 ニジマスの腸の健康状態です [J]。 魚 Shellf Immunol、 2023 134:
1050-4648。
[33] majy, piao xs, mahfuz s, et al。腸内微生物間の相互作用、腸バリア、短鎖脂肪酸[j]。anim nutr, 2022, 9: 159-174。
[34] スウェインソン g, forsyth cb, tang, ym, et al。腸の概日リズムの役割 リズム 遺伝子 in alcohol-induced intestinal hemophagia [J]。2011年アルコールClin Exp Res publica、35 . 1305-1314。
[35] huang jm, yang dx, li xx, et al。腸管粘膜の研究 免疫 and inflammatory 遺体 [J]。 Microb 感染では、 14 2019年(2):113-123。
[36] 、丁J guai jiao Y,白Y,らβ-Glucan阳诱autophagy樹状細胞や影响力とピンで分化 [J]。医学 ^ a b cアポロドーロス、2019年、39 - 48頁。
〔37〕 DI COSTANZO M DE あるクィリルニック氏 N BIASUCCI G。 メチル: A 食物アレルギーの発症における早期栄養と腸内マイクロバイオームの関連[j]。約数の和は1201(4)。
[38] 張 YZ、 柳 XN、 趙 J et アル The phagocytic receptors βの-glucan [J]。^ a b c d e f g h『仙台市史』、20205 - 441頁。
[39] 忠 QH、 王 ZL、 呉 Y et アル 研究 進歩 on 相互作用 間 食物 繊維 and intestinal microorganisms 食物アレルギーの規制で[j]。food sci, 2022, 43(3): 239 - 248。
[40] li c, xing qb, sun gj, et al。研究の効果に証拠あまりの寒呈するオート麦の/麦β-glucanか[J]。^ a b c d e f g h i『官報』第2042号、大正4年(1915年)4月4日。
[41] xu md, mo xx, huang h, et al。酵母β-glucan緩和認知赤字腸microbiota規制されや中の代謝物のβ1-42-induced AD-likeネズミか[J]暴れる。IntJ Biol Macromol 20/20、161:258-270。
[42] 張 f,ファンdj,黄jl, らマイクロバイオーム(腸microbiome):食物連鎖 繊維 to inflammatory 病気 [J]。 医学 Microecol、 2022, 14 . 2590-0978。
[43] 申RL、王ZC、八尾HY。オート麦のβ効果-glucan腸内細菌叢に至っネズミか[J]。food sci, 2005,(2): 208 - 212。
[44] lv zy, ma d, xu hg, らオート麦のβ効果-glucan原因と結果を取り違えている腸内細菌叢に至っ高脂肪食ネズミか[J]暴れる。j food saf qual, 2021 12(12): 5024-5030。
[45] 愛する CL、 ショーン MDB、 LBカン ら 効果 食事パターンβ-glucan on intestinal 微生物 多様性 and サルモネラ ワクチン免疫原性 and 効能 in 豚 [J]。 獣医 Microbiol、 2023 278: 1378-1135。
[46] FEEHLEY t, plunkett ch, bao ry, et al。健康な乳児は食物アレルギーを防ぐ腸内細菌を持っている[j]。nat med, 2019, 25: 448 - 4543。
[47] 马富R t & E STEPHEN-VICTORE CHATILAた食物アレルギーの微生物起源[j]。^『仙台市史』通史編1、通史編2、通史編3、188 - 188頁。
[47] ho h, bunyavanich s .食物アレルギーにおけるマイクロバイオームの役割[j]。喘息Currアレルギー評判は18(4):27 .、2018年
[49] ターナー JA、 STEPHEN-VICTOR E, 王 S et アル 規制 T cell-derived TGF -β,1制御複数の検問所統治アレルギーや自己免疫か[J]免疫約数の和は1205(1)、和は1206(2)。
[50] PERONI DG、ヴェルディG、TRAMBUSTIら。微生物集団構成と its 影響 on the development of アレルギー 病気 [J]。 正面Immunol、2020年。土井:10.3389 / fimmu.2020.00700
[51] satoh-takayama n, vosshenrich caj, lesiean-pottier s, et アル 微生物 植物 駆動 interleukin 22 production in 自然な粘膜免疫防御を提供する腸管nkp46 +細胞[j]。^『官報』第2829号、大正9年(1920年)9月29日。
[52] abril ag, carrera m, sanchez-perez a, et al。食物アレルギーにおける腸内マイクロバイオームのプロテオミクス[j]。^ a b c d e f g h i『官報』第2322号、大正2年(1924年)4月23日。
[53] liu x nagy p bonfini a ら微生物は、腸管幹細胞の分化を免疫依存的に制御することにより、腸管上皮細胞の構成に影響を与える[j]。^ a b c d e f『官報』第2222号、大正12年(1923年)12月22日。
[54] PAONE P 苍井PDさん。粘液バリア、ムチン、腸内マイクロバイオーム:期待される粘性パートナー[j]。腸管、2020年、69:2232 - 2243。
[55] 、SLIVE ZM BLIKSLAGERた。損傷した腸上皮の修復におけるタイトジャンクションタンパク質の役割[j]。2020 Int J索引(Sci) Mol、21(3):972年。
[56] SICARD ジェーン、 BIHAN G VOGELEER P ら 相互作用 腸内粘液成分を持つ腸内細菌[j]。^ a b cアポロドーロス、2017年7月7日。
[57] SUPINDA BUNYAVANICH M BERIN C 食品 allergy and マイクロバイオーム:現在の理解と将来の方向性 [J]。2019年JアレルギーClin Immun 144(6): 1468-1477。
[58] STUMPF F 見 at the 臭い side of 生理機能 輸送 短鎖脂肪酸[j]ですpflugers arch, 2018, 470: 571 - 598。
[59] wang kp, cheng f, pan xl, et al。輸送と吸収の研究 アンジェリカの 虫多糖類 through in vitroおよびin vivoの両方で消化管[j]。^ a b c d e f g h i(2017年)、134 - 134頁。
[60] bai jy, li tt, zhang wh, et al。体系的な評価オート麦のβ-glucan catabolism中 体外消化 and 発酵 [J]。 Food lg化学、2021年まで、ノドゥル348:8308-8146。
[61] 許 A VADDER FD、 PETIA KD、 ら から dietary 繊維 to 宿主の生理機能:主要な細菌代謝物としての短鎖脂肪酸[j]。^ a b c d e f『官報』第1616号、大正5年(1916年)12月16日。
[62] zhang dd, liu j, chne g, et al 腸内微生物相:メタボロミクスと微生物のレビュー[j]。food res int, 2022, 160: 0963 - 9969。
[63] chong j, ma jd, zhang jw, et al。scfasによる腸内免疫調節の研究[j]。^ a b c d e f g h i(2016)、35 - 35頁。
[64] キリスト S DABEK A VOITALA M et アル The 著名な role of ヒストン脱アセチル化酵素阻害剤としてのβ-ヒドロキシ酪酸に対する酪酸比,転写 調整 and 消炎 分子 [J]。 Sci 評判は 742、2019年9(1面)みろ
[65] markus w, kautenbueger t, daumann h, et al。抑制histone-deacetylase activity by short-chain fatty acids and some 結腸で形成されるポリフェノール代謝物 [J]。^ j nutr biochem, 2008, 19(9): 587 - 593。
[66] VA KNETHENにHEINICKE U, WEIGERT A,らヒストン脱アセチル化阻害剤は、制御性t細胞の調節因子として働く[j]。Mol Sci、2020年、21(7):2356。
[67] 日焼け JK、 MACIA L で CR。 食物 fiber and SCFAs in the 粘膜免疫の調節[j]。^ a b c d e f g h i j allergy clin immunol, 2023151(2): 361 - 370。
[68] 狂暴で…予測不能で… A SIDDIQUI N ALHARBI いや et al. 急性 グルタチオンの枯渇は、p38mapk-inosを介して気道反応性と炎症の増強をもたらす 経路 in アレルギー ネズミ [J]。 Int 」。immunopharmacol, 2014, 22(1): 222 - 229。
[69] 愛する CL、 ショーン MDB、 LBカン ら 効果 食事パターンβ-glucan on intestinal 微生物 多様性 and サルモネラ ワクチン免疫原性 and efficacy in 豚 [J]。 獣医 Microbiol、 2023, 278:
1378-1135。
[70] アルエビッチmナレパb CIESIELSKI s異なるタイプの影響β-glucans初期の腸内細菌ネズミmicrobiotaするミルクか[J]渡す2022年、J Funct食品では、89:1756-4646。
[71] costanzo m, paulisn, biasucci g . butyrate:食物アレルギーの発症における初期生活栄養と腸内マイクロバイオームの関連[j]。約数の和は1201(4)。
[72] wang cc wu h lin fh ら酪酸ナトリウムは、離乳豚において腸の完全性を高め、マスト細胞の活性化、炎症メディエーター産生およびjnkシグナル伝達経路を阻害する[j]。^パウサニアス、2017年4月24日、44 - 46頁。
[73] rorie jw, keown nm。専門は繊維工学 the 胃腸 腸管: の 減少させるため アプローチ to 不溶性・可溶性繊維に関する長年の誤解を解消[j]。j acad nutr diet, 2017, 117(2): 251 - 264。
[74] 司馬 P VANNUCCI L VETVICKA V β-glucans and コレステロール(Review)か[J]と呼ばれている。^『官報』第491号、大正9年9月18日。
[75] 刘B杨、 t, luo y, et al。オート麦のβ-glucan adipogenesisと肝を抑えるsteatosisで高脂肪diet-inducedhyperlipidemicハツカネズミAMPK経由シグナリングか[J]。^ a b c d e f g h e f g h 2018, pp . 78 - 78。
[76] mo xx, sun yh, liang xl, et al。不溶性酵母β-glucan減衰高脂肪 diet-induced 肥満 by regulating gut microbiota and 役立ちますか[J]。カルボヒードpolym, 2022, 281: 8144 - 8617。
[77] seiichiro a, yasunori i, noriko k, et al。効果の高いβ-glucan麦 on 内臓 脂肪 肥満 in 日本 個人: A 無作為化二重盲検試験[j]。^パウサニアス、2017年4月1日、1 - 6頁。
[78] CHAKRABORTY S RAJESWARI VD。 生物医学 態様 of β-グルカン-グルコース代謝とその一次遺伝子pik3r1上の役割[j]。2022年、J Funct食品では、99:1756-4646。
[79] guo hq, wu hl, kong xq, et al。オート麦のβ-glucan ameliorates糖尿病 代謝物を調節することによる高脂肪食とストレプトゾトシン誘導マウス[j]。jnutr biochem, 2023, 113: 2955 - 2863。
[80] wu lj, zhao j, zhang xn, et al。Antitumor水溶性βの効果-glucan免疫か[J]覚醒剤0.097。Int J Biol Macromol、2021年まで、179:116-124。
[81] CHOROMANSKA A KULBACKA J REMBIALKOWSKA N et al.低分子オーツベータグルカンの抗がん特性in vitro研究[j]。2015年Int J Biol Macromol、80:23-28。
[82] xie wy, shao f, duan xh, et al。全β-glucan粒子減衰 火星の水に/ DSS-induced 大腸 tumorigenesis in mice を介して 抑制 腸の炎症[j]。2023年Pharmacol前いる。土井: 10.3389 / fphar。2023.1017475
[83] 張 XR、 李 TT、 柳 SW、 et al. β-glucan from しいたけ 产乳がん進行を抑えるNur77 / HIF-1を介してα軸か[J]Biosci評判は見込みだ。土井:10.1042 / BSR20201006


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本



