papainパウダーを固定する方法?
Papain [EC 3.4.22.2] is an important biochemical product with widespread applications in the food and pharmaceutical industries, as well as in feed, textiles, and leather processing [1]. Due to the high cost of papain and its inability to be reused, researchers have been exploring the preparation of immobilized papain. This research began in the early 1960s and has since been extensively documented in the literature [2]. The main methods for enzyme immobilization include embedding, adsorption, covalent bonding, and cross-linking, each with its own advantages and disadvantages [3]. This paper summarizes recent research and application progress on immobilized papain, compares the enzymatic characteristics such as enzyme activity, stability, and recovery rate of immobilized papain prepared using various immobilization methods in recent years, and provides suggestions.
1埋め込み方法
埋め込み法:多孔質の担体に酵素や酵素を含む細菌細胞を埋め込み、酵素を固定する方法を埋め込み法といいます。ゲル埋め込みとは、様々なゲルの微細な多孔質構造に酵素を埋め込み、特定の形状の固定化酵素を生成する方法である。最も一般的に使用されるゲルは、寒天、アガロース、アルギン酸カルシウム、カラギーナン、およびポリアクリルアミドです。Microcapsule埋め込み半透過性高分子膜内に酵素を封入し、マイクロカプセル化固定化酵素を生成する。
1.1アルギン酸ナトリウム-キトサン固定化パパイン(ipsac)
エイコサペンタエン酸は、褐藻から抽出された多糖リンクグルクロン酸作曲β−1、4債券。簡便な固定化法、温和な条件、室温での操作が可能なため、酵素の不活性化を最小限に抑えることができ、酵素カプセル化に最適なキャリアです。しかし、アルギン酸カルシウムゲルは、多価アニオン(リン酸塩、クエン酸塩、乳酸塩など)や高濃度の電解質(k +、na +)を含む溶液中では不安定であり、ca2 +イオンは容易に分離し、ゲルを軟化させたり溶解させたりする。師事しら[4]の固定化缓和ナトリウムによりpapain alginate-chitosan 2つの面があり:まず、中Tris-hydrochloric酸緩衝溶液として使われてゲル準備Ca²を減らすため、⁺イオン地帯のジェル安定維持は;次に、まずキトサン粉末を添加してゲルの硬度を高めた。キトサンの正電荷(- nh)はアルギン酸のカルボキシル基と相互作用し、ゲルを安定化させ、カラム充填に適している。固定化酵素の酵素活性は、キチン粉を含まない酵素の活性と同じであった。
in he et al.'s[4]試験では、paおよびipsacの最適ph値は7.2であり、70°c以下の温度でも活性が安定していた。埋め込まれたpaの空間構造は変化しなかったため、最適なph値と熱安定性はほとんど変化しませんでした。ipsacの半減期は59日である。
アルギン酸ナトリウム-キトサン固定化パパイン(ipsac)は、良好な熱安定性、長い半減期、高いゲル硬度を示し、カラムローディングに適しており、工業環境での自動生産に便利です。
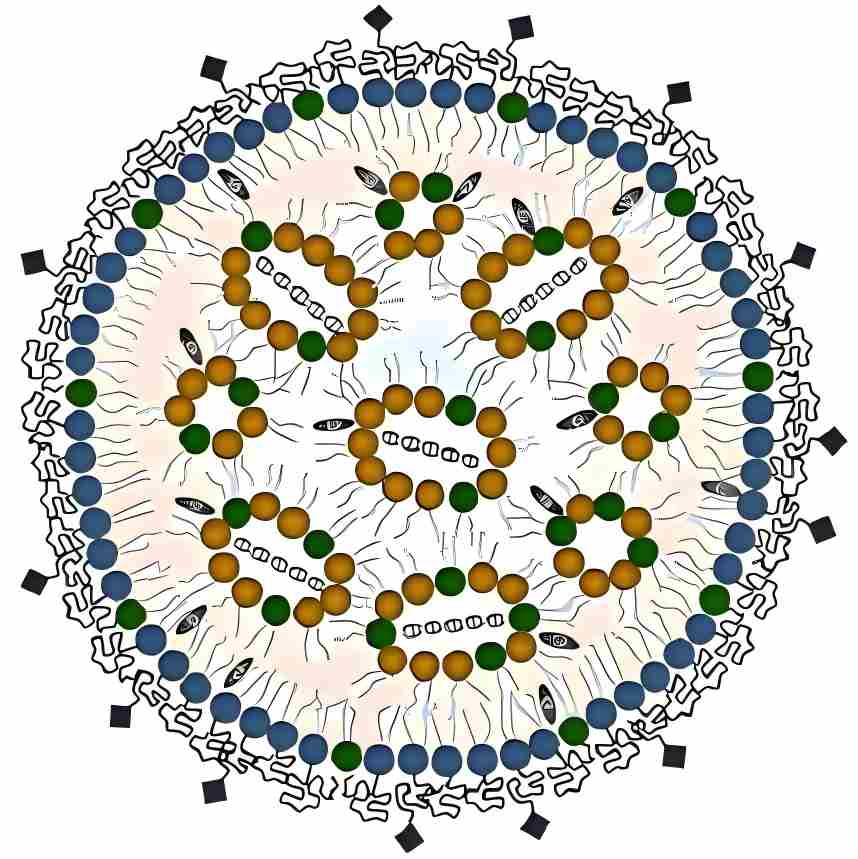
1.2 papainを固定化するためのキトサンカプセル法
*アミン・脱アセチル化キチン(脱アセチル化キチン)とも呼ばれる。キトサンは酵素担体として化学的安定性や熱的安定性に優れており、固定化酵素の担体として優れている。
huang zeyuan[5]は、キトサンとカルボキシメチルセルロースをカプセル化してpapainを固定化し、酵素負荷500 mg/10 ml、キトサン濃度0.2%、ph 7.5、温度50°cの最適な酵素固定化条件を決定した。働かされていないパパインの活動回復率は69.8%に達した。
2. 吸着方法
吸着法:酵素や酵素を含む細菌細胞を固体吸着剤の表面に吸着させて固定化する方法を吸着法といいます。一般的な吸着剤には、活性炭、酸化アルミニウム、珪藻土、多孔質セラミックス、多孔質ガラス、シリカゲル、カルボン酸などがある。固定化酵素を調製する吸着法は、操作が簡単で、条件が温和で、酵素変性や不活性化を起こさず、安価で入手しやすい担体を使用し、再利用が可能である。しかし、物理的な吸着力が弱いため、酵素担体複合体は不安定で剝離しやすいため、工業生産への実用化が制限されていた。この分野の研究も比較的少ない。
2.1メソポーラス材料中でpapainを固定化するための凍結真空吸着法
組み立てには様々な方法がある機能資料メソポーラス分子ふるいの孔では、気相吸着および含浸を含む。従来の吸着法と比較して、従来の吸着法に比べて駆動力が強く、タンパク質吸着率が高いという利点がある。次に、低温で酵素活性を維持する。
gao boら[6]は、メソポーラス材料sba-15を担体として固定化されたpapainを調製した。固定化酵素と溶液酵素の特性を比較したところ、papainの最適温度は固定化後60°cから70°cに上昇した。この酵素の固定化後の最適なph値は7.0であったが、最適なph値は変化しなかった。これはメソポーラス分子篩sba-15の表面電荷が中性であることによるものと考えられる。固定化酵素と溶液酵素を一定量取り、30 ~ 90°cで30分間培養し、室温まで急速に冷却した後、37°cで酵素活性を測定した。

papainが分子ふるいに組み立てられた後、その熱安定性は著しく向上した。90°cで30分間培養した後も、溶液酵素は90°cで既に活性を失っていたが、活性の70%を維持した。このことは、酵素を分子ふるいに組み立てることで、熱安定性を高めることができることを示している。高温は、反応速度を向上させ、細菌汚染を減少させるだけでなく、基質への溶解性を向上させ、歩留まりを向上させるため、メソポーラス材料sba-15を担体として調製した固定化酵素は、優れた熱安定性を示し、工業用途に適しています。
実験の結果、適切な真空条件下では、凍結真空吸着法を用いることで、高い組立効率で固定化酵素を調製でき、酵素活性が高い安定性で良好であることが示された。したがって、凍結真空吸着は酵素タンパク質を固定化するための新しい方法となる可能性があります。
3共有結合法
共有結合法:酵素活性中心の外側にある非必須基と固相担体上の基を共有結合させて固定化酵素を作る方法を共有結合法、または共有結合法といいます。共有結合法は現在最も活発に研究されている固定化法の一つである。酵素とキャリアの強い結合、剝離しにくい、長期間連続使用できるなどの利点があります。
しかし、次のような欠点もあります。(1)固定化の過程で、酵素分子とキャリア分子の間で直接(硬い)衝突が起こり、酵素を変化させる可能性があります#39;の構造と不活性化を引き起こす;(2)担体は一般に疎水性物質である。酵素が直接固定化された疎水性キャリア、酵素'の微小環境は、酵素タンパク質のコンフォメーション変化、折りたたみ、または変性につながる、変更されます。お供に従え;(3)従来の共有結合法では、酵素が固定化されていて移動の自由度が低く、酵素分子と基質との間に立体的な障害があり、酵素の自由状態の均一な触媒活性を維持することが困難であった。したがって、この方法は「剛体固定化」と呼ばれます。
共有結合のための一般的なキャリアはセルロース、デキストラン、アガロース、キチンである。本稿では、papainを固定化するための新しい共有結合結合法に焦点を当てた。

3.1 bis-aldose澱粉を用いたpapainの柔軟な固定化
共有結合法の問題に対処するために、研究者たちは担体表面に短い鎖(アーム分子)を結合させることで、酵素の「アームによる固定化」を実現することを提案した。しかし、これらの腕鎖は低分子量の短鎖であり、一部は疎水性炭素鎖であるため、酵素分子は固定化時に大きな衝撃力を受け、構造変化や不活性化を引き起こす。wang haiping、wei rongqingら[7 - 8]は、「柔軟な鎖」と呼ばれる固定化キャリアに十分な長さの親水性分子鎖を取り付け、酵素をその柔軟な鎖に結合させる「柔軟な固定化酵素」モデルを提唱した。図1に示すように、papainの柔軟な固定化を実現するために、以下のステップを用いた。
酵素柔軟固定化モデルを用いて、キトサンとビスアルデヒドデンプンを用いて柔軟担体(キトサン- das50)を作製し、papainを柔軟に固定化した。固定化酵素の活性回復率は72%に達し、キトサン-グルタルアルデヒド(キトサンga)アームキャリアの3倍に達した。柔軟に固定化されたpapainは、7 - 8バッチで活性の半分を保持し、遊離酵素よりも高い貯蔵安定性を示した。
その結果、「柔軟な固定化法」は、固定化過程における酵素の不活性化を抑制するだけでなく、固定化酵素が遊離酵素に比べて高い均一な触媒活性を保持することを保証することが分かりました。
3.2磁気ポリマーマイクロスフィア上でのpapainの固定化
磁性ポリマーマイクロスフィアは、磁性金属または金属酸化物(鉄、コバルト、ニッケル、およびそれらの酸化物など)を含有し、磁気応答性を示す超微細粉末です。これらは、過去20年間に開発された新しい機能性高分子材料です。共重合や表面改質などの化学反応により、様々な反応性官能基(ヒドロキシル基、カルボキシル基、アルデヒド基、アミノ基など)が共重合や表面改質などの化学反応により生成します。これらの官能基は酵素や抗体などの生理活性物質と共有結合を形成する。外部磁場の影響下で、これらの微小球は急速な移動や分離を受けることがある。このため、磁性ポリマーマイクロスフィアは、新しいタイプの機能性高分子材料として、生物医学、生命工学、酵素固定化などの分野で幅広い応用が期待されています。
zeng lixiら[9]は、機能性エポキシ基を豊富に有する表面を有する、高親水性で均一な大きさの、十分に分散した磁性ポリマー多孔性複合微小球を合成し、これを用いたの固定化papain。カゼインを基質として、固定化酵素の酵素特性と速度論的パラメータを研究した。その結果、固定化酵素の最適反応温度は80°cであった。90°cで40分間培養した後、固定化酵素は元の酵素活性の65%を保持したが、溶液酵素は元の酵素活性の6.6%しか保持しなかった。最適反応phは7.5であった。phが6.0 ~ 8.5のとき、固定化酵素は遊離酵素よりも高い活性を示し、酵素活性回復率は55.2%であった。固定化酵素は、遊離酵素と比較して、酸塩基耐性が高く、熱安定性、ph安定性、動作安定性が著しく向上しました。
磁性ポリマー多孔性複合微小球固定化papainは、優れた親水性、生体適合性、大きな表面積、高機能エポキシ基を有するキャリアで、高活性で高性能な固定化酵素の調製を可能にします。担体の磁気的な応答性を利用することで、酵素を外部磁場下で反応系から容易に分離できることから、生化学反応に触媒を利用する傾向がある。
3.3金属キレート化キャリアpapainの固定化
金属キレート親和性クロマトグラフィー(metal chelation affinity chromatography, imac)は、金属キレート配位子とタンパク質表面上の電子供与性アミノ酸(ヒスチジンのイミダゾール基やシステインのチオール基など)との間の配位結合を利用して、分離と分離を達成するタンパク質を浄化する。。金属キレート化キャリアは、その表面に固定化されたタンパク質のコンフォメーションにほとんど影響を与えず、再利用することができます。この技術を固定化酵素に適用することで、現在使用されている固定化キャリアと方法の限界の一部を克服できる可能性がある。
使われた柳琳琳ほか[10]磁性金属chelatingも使用microspheres交流をキャリア・搾取の疑惑メタル配糖chelatingとして(IDA-Cu²⁺)アミノ酸electron-donatingタンパク質面への残さpapainないね固定化最適な条件はクー²だっ⁺1.5×10 ^(−2)mol / g、タイム4 h固定化pH 7.0固定化酵素装着30ミリグラムと搬送波/ gに使用する。最適反応温度は70°c、最適反応phは8.0である。固定化酵素の熱安定性は溶液酵素よりも有意に高い。固定化酵素の酵素活性回復率は68.4%であり,良好な動作安定性を示した。キャリアを5回繰り返し使用すると、固定化酵素の酵素活性は最初の固定化酵素の79.71%である。

その結果、papainの固定化のために金属キレート担体を使用した場合、固定化反応条件は穏やかで、酵素への影響は最小限であることが示された'の高次構造、高酵素活性回復;固定化酵素の熱安定性は著しく改善された;キャリアは、高い酵素負荷能力を有する;担体の再生と酵素の固定化は簡単に操作できます;固定化酵素と担体を複数回再利用でき、固定化酵素の製造コストが低い。したがって、この技術は産業界への応用の可能性が高い。
3.4可溶性固定化パパイン
従来の方法で製造された固定化酵素は、安定性に優れ、回収が容易であるなどの利点があるが、不溶性で高粘度の基質溶液には適用が制限され、触媒効率が低い。酵素の触媒効率が低いのは、固体相と液体相の間の非均一な反応系で酵素触媒反応が起こるためであり、その結果、均一な遊離酵素反応系と比較して酵素-基質接触確率が著しく低い。したがって、固定化酵素の触媒効率を向上させるためには、触媒反応系を最適化し、均一な触媒反応系を形成できる固定化酵素を作製する必要があります。
李、ら。[11]共役papain (PP) carboxymethyl酢酸セルロースフマル酸還元(As-L)水溶性スナイパーPPに備えさせた。引換回収された最適なpH値無料および水溶性PPされ6.0 5.0、それぞれ一般的な膠芽腫反応60°C 70°Cの寒さとKm 3.07 mg・2.53 mLの価値。可溶性の固定化ppは、60°cで12時間の潜伏期後も62%の活性を維持し、62%の活性は維持された。4°cで、30日後に、活性は90%以上維持されました;ph 6.0では安定性が最も高く、4.0 ~ 7.0の範囲で比較的安定していた(相対活性>80%)。可溶性固定化ppは、ph 5.5以上の溶液に完全に溶解し、最適ph範囲が狭く、最適温度が高く、km値が高い。熱と酸塩基の安定性が大幅に向上しています。
可溶性固定化パパインは、遊離パパインの高い触媒活性と不溶性固定化酵素の高い安定性と容易な回収性を兼ね備えており、産業用途への幅広い応用が期待されます。
4架橋方法
架橋法:架橋法とは、二機能性試薬を用いて酵素分子間または酵素分子と固相担体との架橋を誘導し、固定化酵素を生産する方法です。一般的に使用される二機能性試薬には、グルタルアルデヒド、ヘキサメチレンテトラミン、無水マレイン酸、ビス(2-ニトロ-5-ニトロフェニル)アミンがある。これらの中で、グルタルアルデヒドが最も広く使用されています。架橋法によって固定化された酵素は強い結合を示し、長期間使用することができる。しかし、架橋反応の激しい性質のために、酵素分子の複数のグループが架橋され、酵素活性が著しく低下します。実用的な応用では、この方法は他の固定化法(例えば、ゲルカプセル化後の架橋法)と組み合わせられることが多い。固定化のために2つ以上の方法を用いるこの技術は、デュアルまたは多重固定化と呼ばれる。この方法を用いれば、高い酵素活性と優れた機械的強度を持つ固定化酵素を作ることができる。
クロスリンクは、papainを固定化するために最も一般的に使用される方法である。この分野の研究は中国で早くから始まっていたので[12 - 13]、新しいキャリア材料にpapainを固定化する架橋法の最新の研究用途の一部を挙げることにする。
4.1 Silk-immobilized papain
chen fangyanらは[14]、活性化シルクフィブロインを担体として用い、共有結合架橋法を用いてpapainを固定化し、シルクフィブロイン固定化パパインの酵素的性質を調べた。その結果、絹フィブロインは親水性ポリマーであるため、絹フィブロインを担体として調製した固定化papainは、基質に対する親和性が著しく向上した。固定化酵素の見かけ上のmichaelis定数km app[カゼイン]は0.092%であり、溶液の0.46倍であった(図2)。最適なphは7.5でしたph値6.5 ~ 8.0では、酵素活性は4.0 ~ 55°cの温度範囲で安定している。半減期は溶液酵素で38日、固定化酵素で54日である。固定化酵素の作用半減期は溶液酵素の作用半減期よりも有意に長い。
4.2担体としてオバルブミンを使用した固定化papain
huang yibingたち[15]は、変性オバルブミンを直接担体として用い、従来の架橋固定化法と組み合わせて、グルタルアルデヒドを架橋剤としてpapainを固定化することに成功し、操作手順を簡素化した。オバルブミンを担体とする固定化パパインは、同じ反応条件で、固有酵素では60°c、固定化酵素では90°cの最適な反応温度を示すことが示されている。
固定化酵素の最適反応温度を上げた。また、固定化されたパパンの最適ph値はアルカリ度が8.0に移行し、オバルブミン粉末をキャリアとして使用した固定化パパンの酸安定性は大幅に向上した。100°cの熱湯浴で5時間処理したところ、固定化されたpapainは54.6%の活性を維持したが、溶液酵素は2.5時間の処理で完全に酵素活性を失った。実験の結果、固定化されたパパインは、環境条件下で高い安定性を示すことが示された。安定性は固定化酵素の実用化を決定する重要な要素である。多くの場合、酵素の安定性は固定化後に上昇し、非常に有利である。
4.3 Chitosan-immobilized papain
Chitosan-immobilized papain is currently a relatively mature method for immobilizing papain [16–18]. The main method involves using chitosan as a carrier and glutaraldehyde as a cross-linking agent to prepare immobilized papain [18]. Using chitosan as a carrier, the method for preparing immobilized papain is simple, with mild immobilization conditions, and the resulting immobilized enzyme exhibits significantly improved heat resistance and thermal stability, making it a commonly used method for immobilizing papain.
5まとめと展望
いくつかの派生型が存在する。これらの広範な研究から、酵素が固定化された後、キャリアや他の要因の影響によりその特性が変化することが観察できます。したがって、固定化酵素の応用においては、その応用を最適化するためには、固定化酵素と遊離酵素の特性の違いを理解することが不可欠です。それに応じてプロセスを調整することで、反応を効率よく触媒するための最適な条件で酵素を操作することができます。研究者間で実験設計が異なるため、様々な固定化手法の長所と短所を評価することは困難です。様々な方法で調製された固定化されたpapainは、異なる適用範囲を有しており、より良い生産に資するために、実際のニーズに基づいて適切な方法を選択する必要がある。
様々な方法で固定化された後、papainは安定性が向上し、最適温度が上昇し、ph耐性範囲が広がり、酵素活性が向上し、半減期が長くなることから、固定化法が適切であることが示された。より良い結果を得るためには、さらなる最適化を追求する必要があります。これまでの研究成果をもとに、固定化酵素の活性と基質親和性をさらに向上させることが今後の研究の重要な課題です。
最近の固定化パパン研究の進展を総括すると、技術の継続的な進歩に伴い、固定化パパンの触媒活性と安定性は満足のいくものであることがわかる。酵素固定化技術は、酵素を繰り返し使用し、原料・製品・酵素を効率的に分離することで、分離工程や設備の簡素化、生産サイクルの短縮、生産コストの削減を実現します。固定化酵素は、産業における酵素の重要な応用形態となるでしょう。酵素の固定化技術の成熟化により、papainは、食品、飲料、医薬品、化学試薬、飼料、繊維、化粧品などにおいて、より大きな役割を果たすことが期待されています。
参照
[1] jone j g . refined papain [j]。1974年(昭和49年)プロセス生化学9(6):方針だ。
[2]雄大が華。papainの応用に関する研究の進捗状況[j]。2006年(平成18年)4月1日-移転。
[3] yao x l, ku h s, song w j .トリプシンを異なる担体で固定化する酵素特性の研究[j]。2007年(平成19年)3月17日:71 - 73。
[4] he ping, huang zhuolie, li chuny, et al。[j] papainの固定化と特性。^『仙台市史』仙台市史編纂委員会、2004年(平成16年)、334 - 338頁。
[5]黄Zeyuan。キトサンカプセルを用いたpapainの固定化に関する研究[j]。^ a b c d e f g h i『科学と技術』、2002年、12 - 12頁。
[6] gao bo, zhu guangshan, fu xueqi, et al。凍結真空吸着を用いたメソポーラス材料におけるpapainの固定化[j]。吉林大学紀要,2005,43(6):66 - 71。
[7] wang haiping, wei rongqing, shen bin, et al。bis-aldose starchを用いたpapainの柔軟な固定化に関する研究[j]。2004年(平成16年)4月1日:ダイヤ改正。
[8] wei rongqing, shen bin, liu xiaoning, et al。キトサン担体を用いたpapainの柔軟な固定化[j]。^『人事興信録』第5版、人事興信録第2版、183 - 187頁。
曽[9]li xi zhen。新規磁性高分子多孔質微小球上での固定化papainの活性と安定性に関する研究[j]。日本学術振興会、2007年(平成19年)3月30日:第1号。
[10] liu linlin, zeng lixi, liu ting, et al。金属キレート担体におけるpapainの方向固定化に関する研究[j]。2005年日刊生命工学、20(5):26-31。
[11] li lingling, zhang tao, yu rong, et al。可溶性固定化パパインの調製と特性[j]。^ a b c d e f g h『中国史』第2巻、1979年、77 - 79頁。
【12】陶國良、李延峰。アンモニア処理した球状ポリ塩化ビニルに対するpapainの固定化に関する研究[j]。1993年(平成5年)3月10日- 2号機が完成。
[13] tan huiying, chen xuelin。マイクロビーズ上でのpapainの固定化と赤外線活性化[j]。 1993年(平成5年)3月17日- 20日。
【14】陳方岩、紀平雄。シルク固定パパインの特徴に関する研究[j]。^ a b c d e f g h『日本農業史』第26巻、1982年、84 - 83頁。
[15] huang yibing, wu xiaoxia, wu shengnan, et al。オバルブミンを担体として用いたpapainの固定化に関する研究[j]。日本学術振興会,2004,42(4):15 - 20。
[16] huang jianshao, zhang hong。Chitosan-Immobilized Papain [J]。常徳師範大学紀要(自然科学版),2002,14(1):36 - 39。
【17】袁春涛、江顕明。キトサン-g-アクリロニトリル固定化パパインの研究[j]。^ a b c d e f g h i(2002年)、28 - 31頁。
【18】廖丘華。微結晶キトサンによるpapainの固定化に関する研究[j]。^『仙台市史』仙台市教育委員会、1998年(平成10年)12月21日、1 - 2頁。


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本





