ナノギンセノシド製剤の研究
人参 has an important place でtraditional Chinese medicine, とits medicinal value was recorded as early as でShennong&#本草綱目の39;の古典[1]。ギンセノシドは高麗人参の中で最も重要な薬理活性成分の一つだ。血糖調節[2]、抗腫瘍[3]、抗炎症[4]、神経保護[5]、抗疲労[6]など、さまざまな薬理作用があるが、水溶性が低く、生物学的利用能が低く、吸収性が低いため、臨床応用には一定の欠点がある[7]。近年、ナノ医療技術の発展に伴い、ギンセノシドは21世紀を代表する天然医薬品の一つとして、ギンセノシドに関するナノ医療送達システムの開発に研究者の注目を集めている。したがって、筆者は現在のginsenosideナノ医薬品の研究をレビューし、将来の関連する製剤の開発のための参考にしたいと考えている。
1導入
1.1人参saponins
1960年代から高麗人参から100種余りの高麗人参サポニンが分離された。その化学構造は主にアグリコンと糖置換基で構成されている[8]。高麗人参サポニンは、アグリコンと糖質の違いによって、ダムマラン型とオレアナン型に分けられる。シュガー社位置に応じグループdammarane-type ginsenosides 2種類に分けられるに付随する砂糖グループdammaraneリングのはシンボル位置およびC-20位置protopanaxadiolと呼ばれる型なのだが、protopanaxatriolタイプ、における砂糖のメディアパケットC-6に付けられて及びC-20职を务めるdamarane指輪。様々な種類のギンセノシドの化学構造を図1に示す[9-11]。
The ginsenosides that have been widely studied are mainly of the damarane type, such as ginsenosides CKRb1, Rg3, Rh2, Re, Rh1 とRg1, etc. The specific chemical structures are shown でTable 1 [11-12]. However, due to the poor membrane permeability of ginsenosides, the oral bioavailability is usually less than 5%, and the efficacy of direct application is not good [7]. Exploring suitable 麻薬配達システムis an important means of enhancing their medicinal value.
1.2ナノメディシン送達システム
ナノテクノロジーの発展は多くのナノ医療の発展を促進した。ナノ医療は比表面積が大きく、安定性が高く、薬剤負荷が高いなどの特異な薬理作用を持つため、広く研究されている。ナノメディシン送達システムは、溶解性の向上、薬剤の安定性の向上、薬物吸収の促進、薬物放出の調整、免疫認識の回避などによって薬効を改善することが知られている[13-15]。ナノ医療の標的修飾は、より正確に薬剤を病理部位に送達することができ[16-17]、異なる薬理作用を持つ複数の薬剤をコローディングすることで、治療効果を高め、副作用を減らすことができます[18-19]。さらに、ナノ粒子は腫瘍の治療のために広く研究されている[20]。多くの学者を出し説がありの支援nanodrugsを狙っているという腫瘍EPR効果など(拡張通気性を保持効果)、すなわち、の属性を固体腫瘍組織は血管が密集している貧しい廉潔剛胆百折不撓構造リンパ逆流障害、高现地での浸透血管の中濃度のナノ粒子がしやすくなることやliposomes、一部の高分子物質基準値を入り、留まり腫瘍組織[五輪では銅メダル決定戦]ギンセノシドをナノ製剤として調製することは、治療効果を高める有効な方法である。
2治療薬としてのギンセノシド
2.1 Micelles
ミセルは、両親媒性分子の自己組織化によって形成されるナノスケールの高分子の秩序集合体である[23]。分子鎖の疎水性部分がミセルの核を形成し、親水性部分がシェルを形成する[24]。両生類分子は、難溶性の薬剤をカプセル化して、水への薬剤の溶解度を改善し、薬剤の安定性を高め、血液中の循環時間を延長し、組織分布を変化させ、治療効果を高めるために使用することができます[25]。
Ginsenoside CK is the main metabolite of protopanaxadiol-type saponins and has a significant inhibitory effect on a variety of tumor cells [26]. However, CK has poor water solubility and low bioavailability, which limits its clinical application. Zhang etアル[17] prepared a ginseng saponin CK polymer micelle APD-CK with deoxycholic acid-O-carboxymethylchitosan as the carrier modified with a liver cancer-specific targeting peptide A54.
a54ペプチドの修飾により、apd-ckは肝臓がん細胞を選択的に標的とすることができます。APD-CKのIC50値48 h行動をとってHepG2細胞が16.32μg☆mL-1でより大幅に低い无料でCK(28.19μg・mL-1)。さらに、apd-ckの薬物放出はph耐性があり、酸性条件下で放出されやすくなります。このミセルには、リソソームを標的とする能力があるかもしれません。物理的な埋め込みに加えて、薬剤をキャリアに化学的に結合させることも、薬剤搭載ミセルを調製する一般的な手段である。liら[27]は、ギンセノシドrh2とトリプトリドを用いてエステル化pegを二重末端化し、「疎水性・親水性・疎水性」トリブロックポリマーを作製した。このポリマーは自己組織化してミセルとなり、疎水性薬剤の送達に利用される。低ph環境下では血清ヒドロラーゼの作用で薬剤を放出し、安定した複合薬物送達システムとして肺がん治療に利用できます。
2.2 Liposomes
Liposomes are tiny double-layered vesicles composed of amphiphilic phospholipids. Cholesterol is embedded in the membrane to enhance stability. Hydrophobic drugs can be encapsulated inside the lipid bilayer, while hydrophilic drugs can be embedded in the hydrophilic layer of the lipid membrane [28]. Compared with 高分子nanoparticles, they have fewer adverse reactions and are biocompatible. At present, the few FDA-approved nanoformulations are mainly liposomesためintravenous injection [29-30].
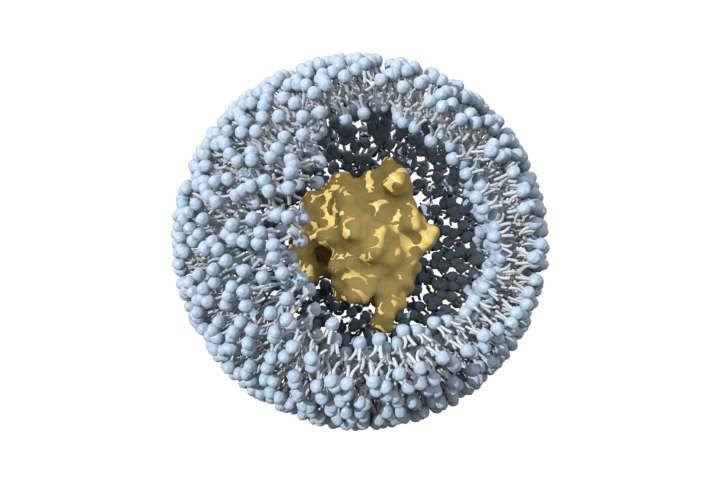
Ginsenoside Rh2 has a good 抗がんeffect in 体外and in vivo, but due to its hydrophobicity and significant efflux mediated by ABCtransporters, its bioavailability is very low [31]. Xu etアル[32] prepared mPEG-PLA modified long circulating liposomes Rh2-PLPand and an octadecylamine-modified cationic liposome (Rh2-CLP). Compared with conventional liposome Rh2-LPboth have better physicochemical and biological properties in vitro and in vivo. PLP can targetdrug 配達to tumor tissue. The fluorescence intensity of DiR-labeled PLP in mouse tumor tissue was 1.3 times that of CLP and 1.6 times that of LP. In vivo anti-tumor studies have shown that Rh2-PLP has the strongest tumor inhibitory effect. This property may be attributed to the PEG modification, which can shield the recognition of liposomes by the reticuloendothelial system (RES), prolong the circulation time of liposomes in the blood, and thus achieve passive targeting of tumors. In addition, other studies have found that the affinity of saponins ためcholesterol and phospholipids can affect the structure and formation of liposomes. When the interaction between cholesterol and phospholipids is stronger than that between cholesterol and saponins, it is more conducive to the stability of liposomes [33-34].
2.3 Nanomilks
ナノエマルジョンは油相、水相、界面活性剤または共乳化剤からなる熱力学的に安定な系である。通常、薬剤と賦形剤を均等に分散させるためには、強い機械的力が必要です[35]。しかし、調製プロセスに必要な界面活性剤の量が少なく、液滴のサイズが小さく、薬剤の吸収を促進することができます[36]。これは、経口投与、注射、皮膚上の局所的な生物活性物質の放出を制御するために研究されている[37-39]。
Ginsenoside Rg1 has low membrane permeability and is not effective when taken orally [40]. In order to improve the oral bioavailability of Rg1, Khattab etアル[41] used Caproyl 90, IPMand Labrafil M1944 as the oil phase, Tween 80, Cremophor EL and Tween 20 as the surfactants, Transcutol HP and propylene glycol as co-surfactants, prepared a Rg1-loaded nanoemulsion SNES. SNEShas an ultra-small particle size of 10.05–13.32 nm, which effectively avoids the phagocytosis of RES. The lipid components in the preparation enhance the ability of Rg1 to penetrate the blood-brain barrier, thereby providing higher brain targeting. After oral administration, the metabolites of the lipid components in SNESsuch as diacylglycerides, monoglycerides and fatty acids, form mixed micelleswith bile acids, which promote the absorption of Rg1 into the blood circulation through the lymphatic system, thereby avoiding the first-pass effect. This nanomilky solution may be an alternative treatment for obese patients with orlistat metabolic disorders.

2.4性アルブミンナノ粒子
Albumin is abundant in serum and has the advantages of being non-toxic, non-immunogenic, biocompatible, and easily chemically modified. Based on these properties, albumin nanoparticles have been widely studied for the 配達of various types of molecules, including chemical drugs, proteins/peptides, and oligonucleotides [42-44].
zhangら[45]は、ギンセノシドrg3上の遊離ヒドロキシ基をエステル化するためにmpeg-saを選択し、ウシ血清アルブミン(bsa)をキャリアとして使用した薬物搭載アルブミンナノ粒子mpeg-rg3-bsa npsを調製した。親水性mpegの導入は、epr効果を達成するmpeg-rg3-bsa npsに資する、薬物の血液循環を大幅に延長することができます。腫瘍部位におけるdir標識mpeg-rg3-bsa npの蛍光強度はfree dirの5.4倍である。フリーrg3と比較して、mpeg-rg3-bsa npは治療効果を高めます。ギンセノシドrg5は水溶性が低く、生物学的利用能が低い。dongら[46]は、rg5 (fa-rg5-bsa nps)を搭載した葉酸(fa)ターゲット修飾されたウシ血清アルブミンナノ粒子を調製するために荒廃法を用いた。これらのナノ粒子は、表面に大量のfaが存在するため、腫瘍細胞を特異的に標的とし、受容体を介したエンドサイトーシスによってナノ粒子の取り込みと内部化を促進し、腫瘍細胞のアポトーシスを誘導する。乳がんモデルを構築MCF-7ことでマウス観測がRg5がんの部位で実効性ある早く(8 h)、、抑制率肿疡の体重マウスの(79.25程度から6.36±)%、よりもはるかに自由Rg5(48.84±9.74%)ずNPs Rg5-BSA FA修正(69.91±11.77%)。
2.5金属ナノ粒子
金属粒子を薬剤担体として用いる場合、静電力、水素結合、ファンデルワールス力などの相互作用によって薬剤を金属担体の表面に充填することができる。近年、金属ナノ粒子は、その比表面積が大きく、機能改変が容易で、安定性が高く、薬剤搭載性が高いことから注目されています。これらは、腫瘍画像化、標的治療、および光熱療法において広く研究されている[47-49]。
Due to the good biocompatibility and automatic liver targeting function of iron-based nanoparticles, Ren etアル[50] prepared Fe@Fe3O4 nanoparticles Np Rg3 coupled with ginsenosideRg3肝細胞がん(hcc)の発生を有意に抑制し、肺へのhcc転移をなくし、肝がんマウスの生存期間を延ばす効果があるという。また、このナノ粒子は、腸内微生物と代謝の間の不均衡なネットワークを再形成し、hccによる腸内微生物の変化を少なくとも12週間遅らせることができ、hcc治療の新しい戦略となる。また、光熱療法と化学療法を組み合わせることも、がん治療の重要な手段です。kimら[51]lactobacillus acidophilus dcy51tを用いてギンセノシドck-auナノ粒子を調製した。表面にカチオン電荷を持っていますepr効果を利用して腫瘍組織に到達すると、腫瘍細胞のアニオン表面に結合し、エンドサイトーシスによって腫瘍細胞に侵入し、腫瘍細胞の溶解を促進します。635 nmの赤外線処理と組み合わせると、ヒト胃がん細胞の増殖に対する阻害効果がさらに高まり、光熱療法と化学療法の相乗効果のある治療薬となります。

3高麗人参サポニン薬のキャリアとして
3.1人参saponins麻薬の運び手として
特異な化学構造を持つギンセノシドは、担体と治療の機能を兼ね備えた新しい薬剤担体として有用である。
(1) ギンセノシドは、疎水性のダムマランまたはオレアナン構造と、親水性のグルコース部分[8]の両方を有しており、ナノ粒子やミセルを自己組織化したり、ナノエマルジョン中で界面活性剤として作用することができる[19,52-54]。(2)高麗人参サポニンはステロール構造を持ち、コレステロールの代わりに新しいタイプのリポソーム膜安定剤として作用する。これらは良好な安定性と強力な腫瘍ターゲティングの特徴を有する[55-56]。(3)高麗人参サポニンは細胞膜中のリン脂質と相互作用することができる。薬物運搬体として使用すると、細胞膜との接触時に一時的なギャップを生成し、薬物の細胞への取り込みを増加させ、比較的短期間で細胞膜の完全性を回復させることができる[53]。(4)ギンセノシド構造のグリコシル基は、グルコーストランスポーター1 (glut1)の基質である。glut1はいくつかの腫瘍細胞で特異的に発現しているため、ギンセノシド自体も特定の腫瘍を標的とする特性を有する[57-58]。(5) glut1は血液脳関門の主要な輸送体でもある。グリコシル基を含む高麗人参サポニンは、血液脳関門を通過することもでき、脳内の標的薬物送達に一定の可能性を有する[56,59]。
(2)
3.2薬物担体としてのギンセノシドの適用
3.2.1自己組織化ナノ粒子の直接形成
Based on the amphiphilic molecular 構成ginsenosides自らナノ粒子を形成し、他の薬剤を担体として塗布することができる。daiらは[52]、低溶解度の天然抗がん化合物(ベツリン酸、ジヒドロアルテミシニン、ヒドロキシカンプトテシン)を誘導するために自己組織化されたギンセノシドrb1ミセルを用いた。調製されたナノ粒子は、高い薬物積載能力(20 ~ 35%)、強力な腫瘍標的性、長い薬物半減期を有していた。liら[19]薄膜分散法を用いて粒子サイズが10 nm以下のジクロフェナックマイクロエマルジョン人参サポニンrb1ミセルの作製に成功した。in vivoウサギの眼角膜貫通試験では、ミセルが角膜に高濃度のジクロフェナクを送達できることが示された。服用すると後diclofenac水準のRb1-Dic政権人でも137.54%—74.93%と255.43%の山よりも高い市販されているdiclofenac眼科解決には時間がチームポイントの0.5は1、2 h、それぞれがあり、新たな戦略目の炎症性疾患の治療た。zouら[53]は、高麗人参サポニン抽出物を膜材料として、インシュリン(ins)を薄膜分散させたインシュリン(ins)ナノ粒子を調製した。ナノ粒子はまた、皮膚に基づいて、細胞間脂質障壁を可逆的に破壊することによって、15分以内に細胞内に急速に浸透することができる'のリザーバー効果は、糖尿病ラット治療モデルにおける製剤の低血糖効果は、初期レベルの約50%で推移しました48時間。
3.2.2リポソームのための膜安定剤
ギンセノシドはコレステロールに似た化学構造を持ち、コレステロールの代わりにリポソームの膜安定剤として用いられる。洪ら[55]liposomes準備包含タキソール全ginsenosideを使いますRh2とリン脂質Rh2はことを確認し、優秀安定の発揚liposomesの性质を先延ばしした血液流通麻薬の間に蓄積推進薬を腫瘍免疫抑制を反転microenvironment。chenら[58]さらに、c- 3置換糖基を有するギンセノシド(ギンセノシドrg3およびrh2など)は、リポソームの血液循環時間を延長し、4 t1細胞表面に発現するglut1に特異的に結合し、腫瘍の標的化能力を高めることが判明した。ギンセノシド構造の糖残基は、血液脳関門のグルコーストランスポーターの基質である[59]。zhuらは[56]、脳腫瘍の標的治療のために血液脳関門を通過することができるパクリタキセルを搭載したリポソームrg3-ptx-lpsを作製するための膜材料としてジンセノシドrg3を用いた。ネズミ用IC 50頭のRg3-PTX-LPs C6神経膠腫でしたがん細胞は0.045μg・mL-1に比べ大きなコレステロールのliposomes C-PTX-LPs(0.149μg・mL-1)。rg3-lpsのグリオーマ領域で検出されたdirシグナル強度はc-lpsの約3倍であり、rg3-lpsの除去はc-lpsよりも遅く、peg-c-lpsに近いことが観察された。このタイプのリポソームには、一定の長期循環効果もあります。
3.2.3ナノマルションとしての界面活性剤
ギンセノシドは、疎水基と親水基の両方を化学構造に含むため、天然の界面活性剤でもある[60]。現在、新機能性食品の設計・開発に向けた研究が進められている。shuら[54]油相として大豆油にアスタキサンチンを、水相として高純度水にギンセノシドを分散させた。高圧均質化により、アスタキサンチンを含むナノエマルジョンを作製することに成功した。比較的低いレベルであっても、ギンセノシドは油と水の界面の界面張力を効果的に低減することができる。ある濃度範囲内では、ギンセノシドの濃度が高くなると、液滴のサイズは小さくなる。しかし、このナノミルキーエマルジョンを高温で保存すると、アスタキサンチンの分解速度が速すぎ、界面活性剤としてのギンセノシドがエマルジョンの安定性に与える特異的な影響については、さらなる研究が必要であることは注目に値する。
4まとめと展望
ギンセノシドは様々な薬理作用を持ち、大きな開発の可能性を秘めた天然薬である。しかし、疎水性が高く、経口バイオアベイラビリティが低いため、臨床応用には限界があります。ナノ剤形の開発は、多くの難溶性医薬品の実用化の手段を提供する。ギンセノシドは、ミセル、リポソーム、ナノミル、アルブミンナノ粒子、金属ナノ粒子などのナノキャリアに直接封入することができ、その生物学的利用能を効果的に向上させることができる。さらに、疎水性のギンセノシド構造中の親水性糖基が特定の界面活性剤の性質を与え、ナノ粒子を形成したり、ナノエマルジョンの界面活性剤として作用することができる。さらに、ギンセノシドはコレステロールに類似した構造を持ち、リポソームの膜安定化剤としても用いられ、その安定性を高めることができる。一般に、ギンセノシドをナノ製剤として調製すると、その生物学的利用能を向上させることができる。ギンセノシドは、ナノ製剤の特性を改善するためのキャリア材料としても使用できます。他の薬剤をカプセル化するために使用すると、相乗的な治療効果を達成することができ、大きな開発価値と応用可能性を有する。しかし、この段階では、薬物キャリアとしてのギンセノシドの研究はまだ初期段階にあり、関連する製剤の開発にはさらなる研究が必要です。

参照:
[1] sun xingyan, sun fengyi, comp.シェンノン&#本草綱目の39の古典[m]。北京:商業新聞、1955年:9。
[2] saba, e kim s h, kim s d, etal。西洋食ldl- / -マウスにおけるギンセノシドrg3高濃度紅参エキスによる糖尿病合併症の軽減[j]。^ a b c d e f g h i j res, 2018,42(3): 352-355。
[3] rosa m t m g, silva e k, santos d t, et al。バイオサーファクタントとしてブラジル人参の根からの水性抽出物を用いた超音波処理によるアナットシードオイルミニエマルションの取得[j]。 j food eng, 2016,168: 382-390。
[4] qi b, zhang s, guo d, et al。四塩化炭素誘発性急性肝障害に対するギンセノシドrg1の保護作用と機構[j]。^ a b c d e f g h i『官報』第2817号、大正8年(1920年)、28 -28頁。
[5] wang r, li y n, wang g j, et al。ギンセノシドrg1の神経保護作用と脳輸送[j]。^ a b c d e f g hi j j j medical, 2009,7(4): 315-320。
[6] yang q y, lai x d, jing o y, et al。老齢ラットにおけるginsenoside rg3の疲労抵抗性およびsirt1に対する影響[j]。2018年は409:144-151。
【7】 金 H 李 J H 金JE et アルマイクロ/小さなナノサイズ delivery システム ginsenosidesの 上達を 全身性バイオアベイラビリティーか[J]^ a b c d e f g h i『仙台市史』通史編、2018年(平成30年)3月、363 -369頁。
[8] chen w, balan p, popovich d g .第6章-アジア人参(パナックス高麗人参)とアメリカ人参(パナックスquinquefolius l .)のギンセノシド組成とその変換経路の比較[j]。stud nat prod chem, 2019,63: 161-195。
[9] mohanan p, subramaniyam s, mathiyalagan r, et al。ギンセノシドrb1、rg1、およびrg3の分子シグナルとその作用機序[j]。J人参Res publica 42(2): 123-132。、2018年
[10] xu x h, li t, fong cm v, et al。抗がん剤としての漢方薬からのサポニン[j]。2016年分子1326 21(10日):"。
[11] wang h, zheng y, sun q, et al。ギンセノシドは、強化された抗腫瘍療法のための二機能性医薬品およびナノキャリアの両方として浮上している[j]。J Nanobiotechnol、2021年、19(1):322。
[12] piao x m, zhang h, kang j p, et al。サポニン多様性の進展[j]。2020分子25(15):3452。
[13] BISWAS S, クマリ P LAKHANI P M et アル 最近 進歩 in polymeric micelles for anti-cancer 薬物伝達[J]。ユーロj pharm sci, 2016,83: 184-202。
[14] shishir m r i, xie l h, sun c d, et al。生体高分子や脂質系トランスポーターを用いた生体活性化合物のマイクロ・ナノカプセル化の進展[j]。動向食品Sci技術、2018年、78:34-60。
[15] dey t k, koley h, ghosh m, et al。epa-dha rich oil in water nanoemulsionによる脂質バイオアクセシビリティとex vivoバイオアベイラビリティに対するナノサイジングの影響[j]。^ a b c d e f g h『化学の歴史』、2018年、275 - 135-142頁。
[16] hoon h, ho p m, gayoung j, et al。乳がん治療のための葉酸機能化シクロデキストリン-パクリタキセル複合体を含む注射用グリコールキトサンハイドロゲル[j]。います、2021年まで、11(2):317。
[17] zhang j m, jiang yy, li yp。ギンセノシド化合物kを肝臓がん細胞に標的送達するために、アキトサン由来ホーミングペプチドで修飾したミセル[j]。カーボハイドポリム、2020年、230:115576。
[18] sun j j, liu y h, chen y c, et al。併用療法用のレドックス応答性ダサチニブ含有高分子プロドラッグ担体によって送達されるドキソルビシン[j]。^ a b c d e f g h i『官報』第2325号、大正7年、258 - 258頁。
[19] li m s, lan j, li x f, et al。ギンセノシドrb1を用いた新規超小型ミセル:眼薬物送達のためのナノプラットフォームの可能性[j]。^『人事興信録』第1版、2019年1月26日、481-489頁。
[20] gabizon a a、rosales r t m d、la-beck n m .ナノ医療におけるトランスレーショナル考察:オンコロジーの視点[j]。2020 Adv麻薬牧師を运んだり、158:140-157。
[21] golombek s k, may j n, theek b, et al。eprによる腫瘍ターゲティング:患者の奏効を高めるための戦略[j]。Adv麻薬牧師を运んだり、130:17-38。、2018年
[22] park j, choi y, chang h, et al。epr効果との提携:腫瘍微小環境におけるepr効果を改善するための複合戦略[j]。2019年Theranostics 9(26): 8073-8090。
[23] deshmukh a s, chauhan p n, noolvi m n, et al。高分子ミセル:基礎研究から臨床へ[j]。int j pharm, 2017,532(1): 249-268。
[24] jhaveri a m, torchilin v p .薬物送達のための多機能高分子ミセルおよび siRNA [J]。 ^『週刊ファミ通』2014年5月号、57頁。
25 ahmad z, shah a, siddiq m, et al。ドラッグデリバリービークルとしての高分子ミセル[j]。rsc advances, 2014,4(33): 17028 - 17038。
[26] sharma a, lee h j . ginsenoside compound k: insights into recent studies on pharmacokinetics and health- promoting activities[j]。生体物質、2020年、10日(7)、1028。
[27] li p, zhou x y, qu d, et al。共valently conjugated celastrol-polyethylene glycol-ginsenoside rh2の自己組織化ミセルの作製、特性評価および相乗的抗肺がん効果に関する予備的研究[j]。2017年(平成29年)4月1日:834-845系統を廃止。
[28]ダイアナg,アーサーc p, eugenian。薬物送達システムとしてのリポソームの設計[j]。約数の和は1201、和は1201。
[29] de l v, milano f, agostianoa, et al。薬物送達のための高分子/リポソームアセンブリの最近の進歩:表面修飾からハイブリッドベシクルへ[j]。ポリマ-,2021年まで4年(1027 13(7):。
[30] almeida b, nag o k, rogers k e, et al。リポソームを介した薬物送達のための生体共役戦略の最近の進展[j]。2020分子25(23):5672。
[31] gu y, wang g j, wu x l, et al。ギンセノシドrh2の腸管吸収機構:abcトランスポーターの立体選択性と関与[j]。2010年Xenobiotica、40(9):602-612。
[32]徐 L Q,ウ H、尹 S P et al. Liposome-based delivery systems for ginsenoside Rh2: in vitro and in volume vivo比べるか[J]。2015年J Nanopart Res publica、17 (10):415
[33] hao f, hey x, suny t, et al。デオキシコール酸ナトリウムを含むproliposome送達システムによる高麗人参果実サポニンの経口利用可能性の改善[j]。saudi j biol sci, 2016,23(1): s113-s125。
[34] groot c d、musken m、muller-goymann c c。バイデスモードのトリテルペンであるサポニンシェデラコシドcおよびジンセノシドrb1は、リポソーム膜においてコレステロールに対する親和性が低い[j]。J麻薬Deliv sci tec, 2019,53: 101127。
[35] anton n, vandamme t f .ナノエマルジョンおよびマイクロエマルジョン:決定的な違いの明確化[j]。^ a b c d e f g h i(2011) 28(5): 978-985。
[36]食用ナノエマルジョンの進歩:消化、生物学的利用能、および潜在的毒性[j]。^ a b cアポロドーロス、2018年1月1日、81 - 81頁。
[37] maskare r g, indurwade n h, deshmukh ra, et al。ナノエマルジョン:経口薬物送達における可能性の増大[j]。アジアJ化学Tecで、2021年11(1):53-58。
[38] seguy l, groo a c, goux d, et al。疎水性apiの静脈内投与のための非溶血性ナノエマルジョンの設計[j]。Pharmaceutics 20/20、永治元年(1141年)12(12)。
[39] bashir m, ahmad j, asif m, et al。ナノエマルゲル、抗炎症効果の深いジフルニル外用送達のための革新的なキャリア:in vitroおよびin vivo評価[j]。Int J Nanomed、2021年まで16 . 1457-1472います。
[40] he c y, feng r, sun y p, et al。によってギンセノシドrg1およびその代謝物の同時定量 hplc -ラット胆汁、尿および糞中のms / ms: rg1排泄[j]。^ a b c d e f g h i『人事興信録』、2016年、593 -599頁。
[41] khattab a, ahmed-farid o a, nasr s a . ginsenoside rg1ベースの脳内分布を強化 代謝症候群を改善しホメオスタシスのバランスを保つための自己ナノ乳化薬物送達システム[j]。J麻薬Deliv Sciフェアホイゲンで、2021年まで61:1002276。
[42] YHEE J Y 李 J 長 H et al. 分子 撮像 and 対象 drug delivery 使用 albumin-basedナノ粒子か[J]ますCurr Pharm设计、2015年、21(14):1889-1898。
[43] liu z b, chen x y .単純な生体共役化学は臨床的に大きな進歩をもたらす:診断および精密治療のための汎用プラットフォームとしてのアルブミン[j]。chem soc rev, 2016,45(5):1432-1456。
[44] jain a, singh s k, arya s k, et al。タンパク質ナノ粒子:薬物送達のための有望なプラットフォーム[j]。acs biomater sci eng, 2018,4(12):3939-3961。
[45] zhang l j, hui j f, ma p, et al。ギンセノシドrg3に取り込まれたウシ血清アルブミンナノ粒子のペギュラレーション:調製、特性評価、およびin vitro生物学的研究[j]。^ a b c d e f g h nanomater, 2019: 3959037。
[46] dong yn, fu r z, yang j, et al。葉酸を修飾したギンセノシドrg5を搭載したウシ血清アルブミンナノ粒子をin vitroおよびin vivoで標的がん治療に用いる[j]。14 . 6971-6988。2019年Int J Nanomed
[47] rai m, ingle a p, gupta i, et al。生体高分子を用いた貴金属ナノ粒子の生体活性と薬物送達への応用[j]。2015年Int J Pharm、496(2):159-172。
[47]窒息GOKUL P, NAMITHARAN K, ARUL M R, et al. Anisotropic 貴族 金属 ナノ粒子: 合成、 生体センシング,バイオイメージング,薬物送達,theranosticsにおける表面機能化とその応用[j]。^アポロドーロス、2017年、49 - 45頁。
[49] noor n a r, basma aa, natheer h a r, et al。薬物送達における磁性:酸化鉄と置換フェライトナノ粒子の驚異[j]。サウジPharm J、2020 28(7):876-887。
[50] ren z g, chen x m, hong l j, et al。ギンセノシドrg3のナノ粒子結合は、肝細胞がんの発生および転移を阻害する[j]。アッくんは2020年に、16 (2):e1905233。
[51] kim yj, perumalsamy h, markus j, et al。ギンセノシド化合物kを送達するためのlactobacillus kimchicus dcy51tを介した金ナノ粒子の開発:in vitro photothermal effects and apoptosis detection in cancer cells[j]。artif cell, nanomed, biotechnol, 2019,47(1): 30-44。
[52] dai l, liu k f, si c l, et al。ginsenoside nanoparticle: a new green drug delivery system[j]。^ a b c d e f g h『人事興信録』第4版、529-538頁。
[53] zou j j, le j q, zhang b c, et al。特異な透過性を有するギンセノシドナノ粒子によるインスリン経皮送達の加速[j]。Int J Pharm、2021年605:120784。
[54] shu g f, khalid n, chen z, et al。天然乳化剤として高麗人参サポニンを用いて安定化したアスタキサンチン濃縮ナノエマルションの製剤化と特性評価[j]。料理化学があり、255 67 -74、2018年。
[55] hong c, liang j m, xia j x, et al。ginsenoside rh2を用いた腫瘍標的治療用の新規リポソーム送達システム[j]。フェムトLettとして、2020 12日(10日):" 73-90。
[56]朱y梁j m 高 C F et al. 多機能機 ginsenoside Rg3-based liposomes 神経膠腫標的療法のための[j]。^ a b c d e『人事興信録』第2版、大正3年、330 - 641-657頁。
[57] ramani p、headford a、may m t。glut1タンパク質発現は、神経芽腫患者における好ましくない組織学的分類および高リスクと相関している[j]。^『仙台市史』通史編、仙台市、2013年、203 -209頁。
[58] chen c, xia j x, ren h w, et al。ギンセノシドの構造が生体内でのリポソームの運命に与える影響[j]。asian j pharm sci, 2022, 2022,17(2): 219-229。
[59] wang y z, xu q, wu w, et al。グルコーストランスポーターによるギンセノシドrb1の脳内輸送プロファイル1: in vitroとin vivo[j]。^パウサニアス、2018年9月9日、398頁。
[60] rosa m t m g, silva e k, santos d t, et al。バイオサーファクタントとしてブラジル人参の根からの水性抽出物を用いた超音波処理によるアナットシードオイルミニエマルションの取得[j]。j food eng, 2016,168: 68 -78。


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本





