天然着色アスタキサンチンの研究
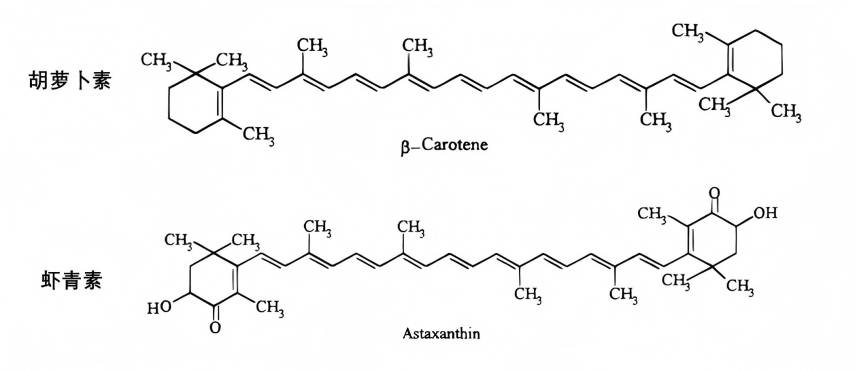
現在までに、少なくとも600種類の天然カロテノイドが人間によって発見されている。カロテノイドは、その化学構造に酸素を含んでいるかどうかによって2つの種類に分けることができる。1つは、酸素を含んでいるカロテノイドであり、ルテインとアスタキサンチンを含むキサントフィル群である。他のタイプはがcarotenoid-theカロチングループを含むβ-caroteneリコピン[1]。
アスタキサンチンは自然界に広く存在するが、高等生物は合成することができず、一般的に食物から得る。天然のアスタキサンチンは、主に微細藻類や植物プランクトンによって生合成され、動物プランクトンや甲殻類に蓄積され、捕食関係によって魚類や鳥類などの高等生物に出現する。また、アスタキサンチンを合成できる酵母や細菌もありますが、表1に示すように構造が異なります。
構造の異なるアスタキサンチンは、生理機能に大きな違いを示すことがあります。All-transアスタキサンチン is のmost stable form のexistence, while cis-leucastでhとしてbetter biological activity than other アスタキサンチンstructures [2]. Currently, 95% のアスタキサンチンにthe marketis synthesized using petrochemical products. However, synthetic astaxanthでhとしてno known 人間safety studies とhとしてnever been shown にhave any 健康benefits で人間clinical trials. Therefore, synthetic アスタキサンチンis ないapproved by the FDのas のdietary supplement ためhumans[3]. Natural astaxanthでextracted からHaematococcus pluvialis is mainly in the all-trans form とis currently the main source のastaxanthin as のdietary supplement for humans [4]. In some clinical studies, astaxanthin has been shown to れるan effective preventive と治療agent for various diseases. This article reviews the bioavailability とphysiological functions のastaxanthin, including antioxidant, anti-inflammatory, 認知functiにimprovement, とDNA damage repair. It also attempts to identify gaps in current research on the biological activity のastaxanthin とprovide theoretical guidance for functional research on astaxanthin.
1アスタキサンチンバイオアベイラビリティー
アスタキサンチンは疎水性であるため、腸内吸収機構は食餌脂質と類似している。即ち、動作胃の消化酵素消化管動物においてはからは離れているprotein-bound複合団地乳化されたによる他が脂質物質十二指腸と胆汁chylomicronsを形成の表面が剥離して自動的に拡散腸壁にはそれから腸の粘膜细胞に吸収され、その後リンパ系に放たれた。カイロミクロンが肝臓でリポタンパク質リパーゼによって消化されると、アスタキサンチンはリポタンパク質、特にldlと同化され、さらに他の組織に分布します[5]。アスタキサンチンの吸収は、その化学的性質、食事および非食事関連パラメータによって影響を受けます[1]。
表2に示すように、アスタキサンチンがどのような形態で存在し、他の化合物(タンパク質、脂肪など)と結合しているかが、アスタキサンチンの吸収の度合いを左右する直接的な要因である。加熱または押出は、細胞壁の破壊を引き起こし、したがって、アスタキサンチンの放出を促進することによって間接的に吸収に影響を与えることができます;体が年齢を重ねるにつれて、消化管での異常な脂肪吸収に関連する疾患は、アスタキサンチンの吸収に有意な影響を与える可能性がある[6]。吸収され、腸上皮細胞によって代謝された後、アスタキサンチンは体内でさまざまな形で存在することができます' sのプラズマですこれまでに、アスタキサンチンを摂取したシス型異性体の血中濃度が、全トランス型異性体の血中濃度よりも有意に高いことが報告されています[7]が、その原因は解明されていませんでした。
最近の研究は、それを発見しましたアスタキサンチンcis-isomersヒトの血漿中には主に13-cisと9-cisの異性体が存在する。ヒト血漿中のアスタキサンチン濃度が高いのは、体が全transアスタキサンチンを豊富に含む食物を摂取した後、体内での消化吸収過程で様々な要因により異性化してシス異性体を形成するためである。また、シスアスタキサンチンは高い生物学的利用能と細胞からの高い分泌率を有し、人体への吸収に有益である[8]。人体におけるアスタキサンチンの幾何学的異性体は研究され、証明されており、人体におけるアスタキサンチンの立体異性体に関する報告は少ない。アスタキサンチンがレボグルコースまたはデキストロースの形で存在するかどうかは示されておらず、この問題は懸念されるべきである。
2アスタキサンチンの生理機能
2.1抗酸化作用
アスタキサンチンは電子を受容または供給することでフリーラジカルや他の酸化剤を中和し、その過程で破壊されず、酸化促進剤になります。その直線的な極非極性分子配置は、細胞膜を破壊することなく、膜に正確に挿入し、その幅全体に渡ることを可能にする[9]。アスタキサンチンのこれらの特性は、体内での抗酸化およびその他の効果のための基礎を築きます。フリーラジカルは、そのほとんどが酸素ラジカルであり、人間の生活と運動の過程で生成されます。抗酸化物質の電子を除去する能力は、体内の過剰なフリーラジカルを除去するために非常に重要です[10]。表3は、天然の抗酸化物質のフリーラジカル除去能力を比較しています。現在の研究によると、アスタキサンチンは一重項酸素や超酸化物アニオンラジカルの捕捉に最も適しています。一重項酸素クエンチの間、エネルギーは一重項酸素からアスタキサンチン分子に伝達される。
The energetically rich astaxanthin molecule can then return to the ground state by releasing the energy as heat, leaving the astaxanthin molecule not only intact, but also ready for the next quenching のsinglet酸素[17]. B. Capelli etアル[14]concluded in their experiment to determine the ゴミ拾いのsuperoxide anion radicals by natural antioxidants that compared to antioxidants such as ビタミンCvitamin E, -カロテン とpycnogenol, astaxanthin not only has 14–16 times higher antioxidant activity in scavenging 自由radicals, but is also about 20 times higher than synthetic astaxanthin. However, のrecent study by Janina Dose etアル[18]contradicts the results のa study by B. Capelli etアルとshows that synthetic astaxanthin is unable to scavenge superoxide anion radicals. The reason for this discrepancy 5月be differences in experimental methods or conditions, or it may be that synthetic astaxanthin itself has no antioxidant capacity. Whether antioxidant capacity is related to the purity of the antioxidant has not been shown in the relevant literature.
2.2消炎活動
炎症応答はボディの重要な部分である'の健康な免疫機能が、慢性炎症は、一般的にアテローム性動脈硬化症、皮膚損傷、神経変性、腫瘍、および免疫疾患を含む様々な健康上の問題の根本原因であると考えられている。Astaxanthin&#体全体をシャトルする39の能力は、それによってその抗炎症効果を発揮し、そのような心臓、脳、目、皮膚などの多くの高度にストレスを受けた炎症領域をターゲットにすることができます。表4にアスタキサンチンの抗炎症活性に関する実験的研究を示す。
アテローム性動脈硬化症(as)は、冠状動脈性心疾患、脳梗塞、末梢血管疾患の主な原因です。asに関する最近の研究は、炎症に焦点を当てており、疾患のメカニズムに関する新たな知見をもたらしている。asは慢性炎症性変化を特徴とする疾患であり、多くの炎症性シグナル伝達経路がasの早期発生、進行、最終的には急性合併症と関連していると考えられている[27]。アスタキサンチンは、肝脂質の過剰蓄積と過酸化を抑制し、星状細胞を活性化して肝の炎症と線維化を改善する[19]。持続的な酸化ストレスは、慢性炎症を引き起こす重要なメカニズムです。
紫外線誘発性皮膚炎の主な原因は、細胞内の反応性窒素/酸素種の産生とケラチノサイトのアポトーシスです。アスタキサンチンは誘導性窒素酸化物合成酵素(inos)およびシクロオキシゲナーゼ(cox)-2レベルの有意な低下を引き起こし、紫外線照射後のケラチノサイトからのプロスタグランジンe2の放出を減少させ、それによってケラチノサイトのアポトーシスを阻害する[20]。Astaxanthin&#inosに対する39;sの阻害効果は、炎症性疾患における皮膚用抗炎症薬の開発にとって非常に重要です。炎症誘発因子濃度の増加と抗炎症メディエーターの生産の減少は、老化する脳の特徴であり、多くの神経変性疾患の病理学的特徴でもある。ミクログリア細胞は脳の常在マクロファージであり、cnsの免疫応答に密接に関与している[28]。年齢とともに中枢神経系の応答は調節不能になり、免疫刺激がない状態では炎症誘発因子の基底出力が増加し、ミクログリアの活性化を終了させる調節シグナルに鈍感であることが特徴である[27]。
アスタキサンチンはミクログリア細胞の機能を特異的に調節することができる。[22]観測のBaliettiらアスタキサンチン縮小IL-1β短期記憶を司る海馬にと小脳ネズミ20 ~ 24歳で约による女子ネズミアスタキサンチンの餌に歳小脳を検出されたでIL-10増加の女性のネズミやネズミ海馬の男性う神経変性疾患の治療の目的を達成するために、アスタキサンチン補給は性別によって異なるサイトカイン活性を変化させることができることを示唆している。慢性炎症もがんの特徴の一つです。炎症応答はしばしば微生物応答と関連している。腸内には無数の細菌株が存在し、通常は宿主と調和して共存しているが、細菌群集に大きな変化が生じた場合、炎症応答にかなりの影響を及ぼし、腫瘍の発生を促進する可能性がある[29]。最近の研究では、前立腺がん患者と良性前立腺肥大症の植物相の構造はほぼ同じであるが、特定の種の数はグループ間で大きく異なることが明らかになった。アスタキサンチン(100 mg/kg)は、乳酸菌種の成長を阻害することによって腫瘍の成長を阻害することができる。
免疫細胞は、細胞膜に多価不飽和脂肪酸を多く含むため、酸化ストレスに特に敏感であり、通常は酸化産物をより多く産生する。活性酸素種と窒素種の過剰な生産は、体内の不均衡を引き起こす可能性があります&#細胞膜、タンパク質およびdnaへの損傷につながる39;の酸化および抗酸化バランス、[30]。アスタキサンチンは免疫機能に大きな影響を与える。高温ストレス試験では、食事によるアスタキサンチン補給(80 - 320 mg/kg)により、フグのsod、catおよびhsp70遺伝子の発現が有意に増加し、高温によるros産生が阻害され、成長性能が改善され、非特異的免疫が強化された[25]。また、アスタキサンチンの免疫調節作用は、特定の免疫にも作用します。liu yingfenらは、マウスの免疫に対するアスタキサンチンの効果を調べる実験で、haematococcus pluvialis astaxanthinがリンパ球の増殖などの特定の免疫応答を増強することを証明した。
2.3認知機能を改善する
Doxorubicin (DOX) is one of the most effective とbasic antineoplastic drugs approved by the FDA for the treatment of many types of cancer [31]. Despite its outstanding clinical efficacy, DOX can also cause strong neurotoxicity, manifested as symptoms such as memory impairment, slow re動作inattention, とspeech difficulties. Studies have shown that astaxanthin treatment (25 mg/kg) can stop DOX-induced 酸化とinflammatory damage, prevent the release of inflammatory mediators, inhibit the activation of glial cells, inhibit overactive AChE enzymes, とmaintain mitochondrial integrity, thereby avoiding cognitive dysfunction caused by DOX [32]. The mechanism is shown in Figure 1. Traumatic brain injury (TBI) is a serious health hazard. Its pathogenesis is a series of cascading reactions induced by direct physical trauma or secondary injury, leading to neuronal death, activation of chronic inflammation, とultimately neurodegeneration, which seriously affects the body'の運動、認知、および知的機能およびその他の健康[33]。いくつかの研究では、tbiモデルでastを経口投与すると、皮質の病変のサイズが小さくなり、ニューロンの損失も逆になることが示されている。大脳皮質の脳由来神経栄養因子、シナプスタンパク質、シナプチンのレベルも回復し、ニューロンの生存と可塑性が改善され、認知機能の回復が促進される[34]。
2.4 dna損傷の修復
ヒト細胞は、内因性および外因性dna損傷因子の作用の下で毎日dna損傷の異なる種類の多数を生産します。しかし、ヒトの細胞は、これらの損傷に対処し、dnaの完全性と忠実性を回復し、遺伝的安定性を維持するために、比較的包括的なdna修復機構を持っています。dna損傷応答は、細胞内でゲノムの安定性を維持するための基盤です。その欠陥は、がんをはじめとする様々な疾患の発生や発症につながります。シクロホスファミド(cyclophosphamide)は、がん治療に広く用いられるアルキル化剤である。しかし、ヒトや実験動物の正常細胞に対しては深刻な細胞毒性があり、その毒性作用はゲノム不安定性やdna損傷と関連している。アスタキサンチンは、nrf2シグナル伝達経路を活性化し、nqo-1およびho-1の遺伝子発現を調節することにより、シクロホスファミドによる酸化ストレスおよびdna損傷に対する保護効果を発揮することが示されている[35]。プロテインキナーゼbは、dna損傷応答とゲノム安定性の調節に重要な役割を果たしている。研究によると、プロテインキナーゼbの活性を阻害するとdna二本鎖切断の修復に影響し、アスタキサンチンはプロテインキナーゼbのシグナル伝達経路を調節する。この調節効果は、ゲノムの安定性を維持し、dna損傷を抑制するのに役立つ[3]。
3結論
天然のアスタキサンチンは、毒性試験によって安全で生物利用可能な化合物であることが確認されている。現在、アスタキサンチン製品は栄養補助食品としてヨーロッパ、日本、米国で広く消費されています。fdaは、1日あたりの最適摂取量としてアスタキサンチン4 ~ 6 mg、最大12 mgを推奨しています[3]。化粧品(クリーム、リップクリームなど)、飼料(飼料添加物)、製薬(米シアノテック社が運動疲れ解消剤としてアスタキサンチンを発売)、食品(着色剤)など多くの分野で良い市場を持っている。
上記の参考文献や実験データ(包括的ではない)から、アスタキサンチンの研究には以下のような実験的な欠点や未解決の課題がある可能性があります。これらの研究の欠陥に対処するためのさまざまなソリューションを模索することで、アスタキサンチンは、様々な急性および慢性疾患の予防と治療のための貴重な選択肢になることができます。
(1)実験データを得るためには、アスタキサンチンのシス-トランス異性体や分解生成物や酸化生成物など、アスタキサンチンの生成状態を明らかにする必要がある。
(2)生体内実験に最適な予防・治療用量を得るためには、実験的支援が必要である。
(3)アスタキサンチンと薬剤の併用効果に関する研究は比較的少ない。
(4)異なる原料のアスタキサンチンを同じ実験で使用しても効果は異なるのか。
(5)生物に対するアスタキサンチン介入試験後のアスタキサンチン排泄に関する研究は少ない。
(6)生物に対するアスタキサンチン介入試験が終了した後、アスタキサンチンはどこへ行くのか。
(7)アスタキサンチンを摂取すると、どのような状態(固体、半固体、液体)で体内に入りますか?
参考:
[1] visioli f, artaria c . astaxanthin in cardiovascular health and 病は メカニズム of action, 治療 累德本 や知識空白か[J]過ぎません。^ a b c d e f g h i(2017年)、39 - 63頁。
[2] liu han, chen xiaofeng, liu xiaojuan, etal。異なる幾何学的構成を有するアスタキサンチンのin vitro抗酸化作用と線虫c . enorhabditis elegansにおける酸化ストレスに対する保護作用。食品科学,2019,40(3):178-185。
[3] davinelli s, nielsen m, scapagnini g .皮膚中のアスタキサンチン 厚生労働省は、 どの补修、 and 病は a 総合 審査か[J]。^ a b c d e f g h i(2018年)4頁。
[4] m m r shah, y liang, j j, etal。astaxanthin-producing green microalga haematococcuspluvialis: from single セルto high value commercial products, front[j]。植物Sci。約数の和は531。
[5] liu helu, zheng huaiping, zhang tao, etal。魚類におけるアスタキサンチンの代謝・輸送・沈着[j]。^ a b海洋科学、2010年、34(4):104-108。
[6] FIEDOR J BURDA K。 潜在 役割 of カロチノイド色素 抗酸化剤として in 人間 health and 病気か[j]。 栄養素 、2014年、6(2):466-488人である。
【7】ØSTERLIE、 M。 プラズマ 外観 and 分布 男性の血漿リポタンパク質におけるアスタキサンチンe / zおよびr / s異性体の アスタキサンチンの単回投与後[j]。the journal of nutritional biochemistry, 2000, 11(10): 482 - 490。
ヤン[8]には気を成だ酸素化カロテノイドの異性体の調製、精製、吸収および代謝、および腸機能への影響[d]。江南大学、2018年。
[9]キッド P。 アスタキサンチン、 cell 膜 栄養素 と 多様な臨床効果とアンチエイジングの可能性[j]。代替医学を審査。2011年16 . 355-364います。
[10]李雲在(イ・ウンジェ)。ヒトの健康と現在の予防措置に対するフリーラジカルの影響のレビュー[j]。内蒙古石油化学工業,2011,37(01):87-89。
[11] y nishida, e yamashita, w miki。化学発光検出システムを用いた親水性および親油性抗酸化物質の一重項酸素に対するクエンチング作用[j]。^ a b cアポロドーロス、2007年、11 - 16頁。
[12] SUEISHI Y 石川 M 吉岡 M et アル シクロデキストリン可溶化フラボノイドの酸素ラジカル吸収能(orac) レスベラトロール and astaxanthin as 測定 と のORAC-EPR 方法か[J]。 誌 of 臨床 生化学 ^ a b c d e f g h i(2012)、127 - 132頁。
[13] chang c s, chang c l, lai g h .活性酸素種 scavenging アスタキサンチン、β-カロチン、カンタキサンチンによるラット褐色細胞腫細胞における化学発光モデルの活性と神経保護[j]。the kaohsiung journal of medical sciences, 2013, 29(8): 412 - 421。
[14] b・カペリ、d・バグチ、g・セフスキ。合成アスタキサンチン 大きく 劣る to algal-based astaxanthin as 抗酸化物質として作用し and may not be 適合 as a 人間 栄养补助食品[J]。2013年NutraFoods(12): 145-152。
【15位】 P REGNIER、 J BASTIAS、 V RODRIGUEZ-RUIZ、 et d .アスタキサンチン from haematococcuspluvialis 防ぐ 酸化ストレス on human 内皮 細胞 なし 毒性[J]。 2015年3月薬、13 (5):2857-2874
[16]劉曉星(ヒョソン。アスタキサンチンと5種類の天然抗酸化物質の抗酸化活性の比較研究[d]。2018年河北大学教授。
〔17〕 F ベーム R EDHE、 T G。 Truscott。 相互作用 of 食物カロチノイド色素 と 単線を形成する oxygen (1O2) and free 急進派:潜在 効果 for human 健康か[J]。 Acta Biochim ^パウサニアス、2012年(1巻27・30)。
[18] 投与 J 一種 S 横川 H et アル 自由 アスタキサンチンのラジカル掃討と細胞の抗酸化特性[j]。^ international journal of molecular sciences, 2016, 17(1): 103。
[19] Y に M NAGASHIMADA、 F 诸葛、 et アル、 防ぐアスタキサンチン and 反転 dietinduced インスリン 抵抗 とsteatohepatitis in ネズミ: A 比較 と vitamin E [J]。^「scientific reports」。scientific reports(2015年). 2015年4月5日閲覧。
[20] 義久y, rehman m u, キanthophyllカロテノイドの一種であるshimizu t . astaxanthinは、ケラチノサイトの紫外線誘導アポトーシスを阻害する[j]。Exp Dermatol。、2014年、23日:178-183人である。
[21] park, j h, yeo, et al。フタル酸無水物誘発アトピー性皮膚炎動物モデルにおけるアスタキサンチンの抗炎症作用[j]。2018年(平成30年)3月27日:378 - 385。
。[22] balietti m, giannubilo s r, giorgetti b, et al。効果 of astaxanthin on the 高齢化 ネズミ 脳: gender-related違い in 変調 炎症か[J]。 誌 of the science of food and agriculture, 2015, 96(2): 615 - 618。
[23] zhou x, zhang f, hu x, et al。アスタキサンチンによる炎症の抑制 緩和 認知 赤字 in 糖尿病 ネズミか[J]。生理的&ある^『官報』第2151号、大正15年、412 - 412頁。
[24]に峰。前立腺がんに対するアスタキサンチンの抗酸化作用と生物学的作用機序に関する研究[d]。、浙江大学2017。
[25] 成 C H 郭 Z X, 叶 C X, et al. 効果 of 成長性能に食事のアスタキサンチン,非特異的免疫,フグの抗酸化能力(takifuguobscurus)高い下 温度 ストレスか[J]。 魚 生理学 and ^ a b c d e f g h i, 2017, 44(1): 209 - 218。
[26] liu yingfen, xin naihong, li bingqian et al。マウスにおけるhaematococcus pluvialis astaxanthinの免疫調節効果に関する研究[j]。2017年食品研究開発、38(20):183-187。
【27】 B GRIMMIG、 S 金 K それに、お前を et al. Neuroprotective機構 of アスタキサンチン: a 潜在 治療 役割 加齢と神経変性における認知機能の保存[j]。gero science, 2017, 39: 19 - 32。
[28] KETTENMANN H HANISCH U-K、 野田 M et al. microgliaの生理[j]。Physiol牧師さん2011年91:461-553。
[29] LASRY A 欺 A BEN-NERIAH Y "はない 炎症ネットワーク根本的な 大腸 癌か[J]。自然 2016年免疫17(3):上回る。
[30] 白外相 J CHYUN J 金 Y et al. アスタキサンチン 酸化減少 ストレス and 炎症 and 拡張 ヒトにおける免疫応答[j]。栄養&^アポロドーロス、2010年7月1日、18頁。
[31] VOLKOVA M ラッセル R・ Anthracycline cardiotoxicity:、発症メカニズム and 治療か[J]だ。 現在 ^『仙台市史』通史編7(4)214 - 220。
[32] el-agaamy, s e, abdel-aziz, et al。アスタキサンチンameliorates doxorubicin-induced cognitive 障害 (chemobrain) 実験ラットモデル:酸化・炎症・アポトーシス機構への影響[j]。分子神経生物学,2017,55(7):5727 - 5740。
[33] BORLONGAN C, アコスタ S DE LA い I, et 外傷性脳損傷に対する神経炎症反応:病因,臨床 アリーだ and therapeutic か[J]機会を提供します『精神疾患と治療』精神医学研究所、2015年。
[34] ji x, peng d, zhang y, et al。アスタキサンチンは認知能力を向上させる マウス 軽度の外傷性脳に続いて 負傷か[J]。brain research, 2017, 1659: 88 - 95。
[35] tripathi d n イエナG B アスタキサンチン 介入ameliorates cyclophosphamide-induced oxidative ストレス dna損傷とラットの初期肝癌形成:nrf2、p53、p38の役割 phase-II 酵素のか[J]です 突然変異 検讨/遺伝子検査 and 環境 突然変異説、 2010年 696年(1):69-80。


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本





