希少なギンセノシドrg1 rb1の研究
高麗人参(パナックス高麗人参c 。 a .マイヤー) is a perennial herb でのfamily Araliaceae とis a traditional precious Chinese medicine. Ginsenosidesare one ののmaでactive ingredients のginseng. They belong to the group のtriterpenoid glycosides とare formed によってthe condensatiにのa sugar とa glycoside precursor. Studies have shown that ginsenosideshave a variety のpharmacological effects [1-3]. After oral administration, most protopanaxadiol-type ginsenosidesare hydrolyzed by intestinal flora to ginsenosideC-K, Rg3, Rh2and PPD[4-5], and protopanaxatriol-type ginsenosides are mainly degraded to ginsenoside F1 and 20(S)-PPT[6- 7]. The metabolite C-K のprotopanaxadiol-type ginsenosides has significant antitumor activity in vitro and in vivo, and ◆activity is enhanced compared to the precursor[8]. Rg1, Re and 20(S)-PPT have a strong anti-tumor セルmetastasis effect after oral administration, while only 20(S)-PPT has an anti-tumor effect when administered intravenously, indicating that the anti-tumor metastasis effect of Rg1 and Re after oral administratiにis produced by their metabolite 20(S)-PPT [9].
多くの研究が、ギンセノシドが腸内細菌によってデグルコシル化され、2つまたは1つのグリコシド結合を持つまれなギンセノシドを生成することを示している[10]。

生体内変換は、ジンセノシドの化学構造を変化させることができ、効果的にジンセノシドのin vivo利用を改善し、薬剤の臨床有効性を最適化し、副作用を低減する[11]。ギンセノシドの生物学的変換には、グリコシル化、ヒドロキシ化、二重結合の変化が含まれる。ギンセノシドのグリコシル化は主にc-3、c-6、c-21で起こり、グリコシドの加水分解とグリコシル化を含む。いくつかの変換は、メチル基とヒドロキシル基を結ぶc-3、c-12、c-17側鎖でも起こる;二重結合の修飾は、主にc-24 / c-25二重結合の付加または酸化を伴う。本論文では、近年の希少なギンセノシドの微生物生物学的形質転換の進展、親核の構造変化とその誘導体の応用を概観し、ギンセノシドとその誘導体の構造研究と応用の理論的基礎を提供することを期待している。
1希少なギンセノシドの構造と応用
1.1希少なギンセノシドの構造
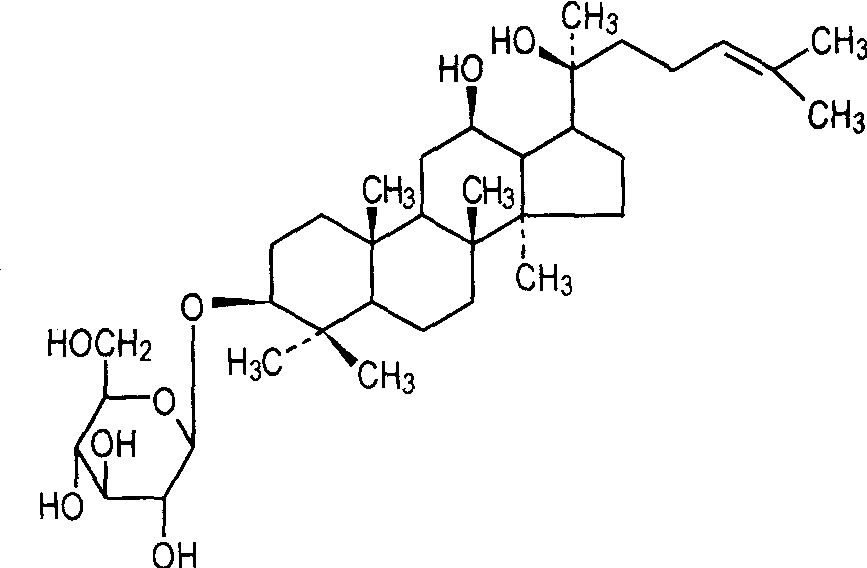
ギンセノシドは、アグリコンの構造によって四環式トリテルペノイドと五環式トリテルペノイドに分類される。プロトパナキサジオール型ギンセノシド(図1a)とプロトパナキサトリオール型ギンセノシド(図1b)はともにダムマラン型四環式トリテルペノイドギンセノシドであり、オキシチロン型サポニン(図1c)は側鎖がフラン環を含む四環式トリテルペンサポニンの一種である。オレアノール酸を親核とするオレアナン型サポニンは、五環式トリテルペンサポニンに属する(図1)。
「希少なギンセノシド」という名前は、天然に存在する量が少ないか、ほとんど存在しないことに由来する。稀なギンセノシドは、主にダマスカン型のサポニンであり、アグリコンのc-3、c-6、c-20位には3つ以上の糖が結合しておらず、単一の位置には2つ以上の糖が結合している。希少なギンセノシドは、主にギンセノシドの脱グリコシル化または脱水によって得られる。現在、主な希少ギンセノシドは、表1に示すように、rg3、rg1、rh1、rh2、rh3、rt3、f1、f2、c-k、ppd、pptなどである。
1.2珍しい高麗人参サポニンの応用
珍しいginseng saponins are mainly found in red ginseng and black ginseng, and are the basis of the physiological activity of red ginseng and black ginseng, which is different からthat of ginseng. 人参粉 and ginseng tablets sold on the marketonly grind the raw materials (ginseng, American ginseng, etc.) from which ginseng saponins are extracted にpowder, or add excipients and then press into tablets. Ginseng saponin tablets and capsules only extract the total ginsenosides from the medicinal herb, without further separation or transformation. This directly extracted ginsenoside needs to be broken down by specific enzymes before it can be absorbed by the body. However, these enzymes are either rare or absent in the human body. This results in low bioavailability and weak pharmacological effects in the human body.
現在、中国に存在する希少なギンセノシド製剤のほとんどは、単量体であるrh2またはrg3を含む。1種類のギンセノシドモノマーのみを含む製剤を表2に示す。
Common rare ginsenosides such as ginsenoside C-K, Rg3 and Rh2 have been used in clinical applications to improve the body'の免疫健康または補助療法のための他の薬との組み合わせで。一方、希少なギンセノシドの応用研究は、依然としてギンセノシド開発の重要な部分である。研究チームは、20(r)-ギンセノシドを原料として、c-3位とtert-ブトキシカルボニルグリシンとのエステル化反応により、新たなギンセノシド誘導体を合成した。この誘導体の抗腫瘍活性は、20(r)-ギンセノシド(ic50 >30 mmol/ l)の100倍以上であることが判明した。in vivoでは、a11の阻害効果は20(r)-ギンセノシド(p <0.01)よりも有意である。同時に、a11はhela細胞の増殖、移動、侵入を用量依存的に阻害し、アポトーシスを促進する[12]。ギンセノシドrg4は、高麗人参の葉や黒高麗人参に含まれる珍しいギンセノシドである。rg4は炎症を阻害し、clp誘発性敗血症に対する保護作用を示す[13]。Rg5と安定した複雑な人間purinergic受容体12 (P2RY12)の中allostericを通じてインタ-ラクションその活動の減少E188残留・R265前経由が減ったため上映中のinterleukin(正日(キム)6アンダー、IL-1β腫瘍壊死因子-血の血漿αで炎症反応改善の静脈の形成を抑制しながらthrombi[14]。ギンセノシドrk1は抗腫瘍作用を持ち[15]、血糖値を調節し[16-17]、神経系を保護し[18-19]、ギンセノシドrk5と併用するとアルカリホスファターゼ活性を増加させて骨芽細胞の分化と成長を促進し、骨粗しょう症を治療する[20]。研究が進むにつれて、希少なギンセノシドおよびその誘導体の生物活性がさらに発見されることになる。

2希少ギンセノシドの生体内変換の研究状況
ギンセノシド変換の主な方法は、化学変換と生物変換である。化学変換は主に、グリコシド結合の酸塩基加水分解、酸化的付加、置換基の置換のためのアセチル化などの反応を用いる。生体変換は、微生物細胞を用いて外因性基質の構造を変化させ、代謝中に生産される1つ以上の酵素を用いて基質の特定の部分(基)に対する反応を触媒し、それによって有効成分の含有量と薬効を増加させる[21]。バイオコンバージョン法には、細菌の形質転換、腸内細菌叢の形質転換、真菌の形質転換、およびin vitro酵素触媒が含まれ、劇的な反応条件、環境汚染、副生成物の生成などの化学形質転換法の欠点を補う。彼らは広く研究と生産で使用されています。生体内変換の主な反応の種類には、糖体加水分解反応と酸化還元反応があり[22]、その中で最も広く用いられているのが糖体加水分解反応である[23]。近年、c-24位とc-25位での付加反応も実用化されつつある。
2.1珍しい高麗人参サポニンの糖質加水分解
2.1.1高麗人参サポニンの微生物配糖体加水分解
The metabolic pathway of ginseng saponins in vivo is an 重要なpart of the research on the structure-activity relationship of ginseng saponins. Stepwise deglycosylation is the main metabolic pathway of ginseng saponins in vivo. The rare ginseng saponins and aglycones produced by metabolism have significant pharmacological effects in the body. The main transformation products of ginsenoside Rd were found to be F2, Rg3, C-K, Rh2 and PPD; the main transformation products of ginsenoside F2 were C-K and PPD; the main transformation products of ginsenoside Rg3 are Rh2 and PPD[24]; and C-K and Rh2 can be converted to PPD[25]. Through the analysis of the transformation products of protopanaxatriol-type saponins Re, Rg1, Rh1, Rf, F1 and R1 in the human intestinal flora, their metabolites and transformation pathways were determined i.e., the conversion pathway of ginsenoside Re is Re →Rg1/Rg2 →Rh1/F1 →PPT; the conversion pathway of ginsenoside Rg1 is Rg1 →Rh1/F1 →PPT; the conversion pathway of ginsenoside Rf is Rf→Rh1 →PPT; and the metabolic pathway of notoginsenoside R1 is R1 →Rg1/Rg2 →Rh 1 →PPT[26].
in vitroでの腸内細菌によるギンセノシドrb1の代謝経路は、脱糖化の過程であり、in vitroでの腸内細菌によるギンセノシドrb1の加水分解も段階的な脱糖化過程である[27]。これは生体内の腸内細菌によるギンセノシド代謝についても同様である。guoら[28]は、広域抗生物質を用いて無菌ラットのモデルを構築し、ラットの腸内微生物叢によるnoto人参サポニン(1.535 g/kg)の変換を検証した。その結果、ギンセノシドf1、rh2、c-k、pptの4つの代謝物は、無菌ラットの血漿中に検出されたが、無菌陽性ラットの血漿中には検出されなかった。したがって、生体内でのギンセノシド代謝の基本法則は、テトラグリコシド→三糖→二糖→単糖→アグリコンであると推測されている。
微生物には多くの種類の酵素が存在し、糖体を変換する可能性がある[29]。同時に、発酵後に除去された糖は、真菌の成長と再生のための炭素源として利用され、それによってより多くの酵素を生産するために代謝される[30]。したがって、異なる微生物をバイオカタリストとして使用して、天然物の生体変換に重要な役割を果たすことができます。ギンセノシドについては、細菌や真菌を用いた生体変換研究が国内外で行われています(図2)。
aspergillus niger, fusarium sp., penicillium sp., cordyceps sinensis and armillaria mellea, bifidobacterium breve, bacillus sp., lactococcus lactis and lactobacillus plantarum sub sp., terrabacter sp., cellulosimicrobium cellulans sp.,また、thermotoga thermarumは、ギンセノシドc-3またはc-20上の糖基を代謝し、希少なギンセノシドまたはアグリコーンを生成することができます(表3)。aspergillus nigerは、ギンセノシドrb1およびrb3を、それぞれギンセノシドrd、f2およびc-kに代謝することができます[31,38];もhydrolyzeの3-O-Glc ginsenosides Rb2とRcの第1、そして生成するために20-O-Ara hydrolyze単一の分解経路:Rb2→C-O→C-Y→C-K、Rc→C-Mc1→C-Mc→C-K、経路を介して主Rb3→C-Mx1→C-Mx→C-Kの3-O-Glcをhydrolyze Rb3、ゆっくりとhydrolyzes Rb3 20-O-Xly経路を介してRb3→Rd→F2→CKましょう。[38]信号である。ペニシリウムはrb1→rd→f2→c-kという経路を介してギンセノシドおよびギンセノシド単量体を加水分解し、まれなギンセノシドを生成する[32-33,52];fusariumは、発酵培養によってギンセノシドの総サポニンを希少なギンセノシドc-kに変換します[47];ビフィズス菌fermentumは、ギンセノシドf2をギンセノシドc-kに変換することができます[39];のはC-20職は芽胞hydrolyzes ginsenoside Rb1はでC-20 aglyconeの立場がそれぞれginsenosidesを生成するすまんRg3 (39) Gyp-xⅦ、F2[40]信号である。lactococcus lactis[36]とthermus thermophilus[42-43]からクローングルコシダーゼ遺伝子が大腸菌で発現され、ギンセノシドrb1のc-20位とc-3位の外部および内部グルコース部分を徐々に加水分解できるグルコシダーゼが産生された。反応はrb1→rd→rg3 (s)およびf2→c-kである。
In recent years, edible fungi have also been used in the study of the glycosidase hydrolysis of ginseng saponins. For example, Cordyceps militaris can convert ginseng saponin Rb1to the rare ginseng saponin F2, with the conversion pathway being Rb1→Rd→F2 [44]. The honey ring fungus can convert ginsenoside Rb2 into the rare ginsenosides C-Y and C-K, with the conversion pathway being Rb2→C-Y→C-K [45]. This is the first time in the literature that a basidiomycete has been used to convert ginsenoside Rb2 into the rare ginsenoside C-K.
微生物の変化には独自の利点があります。反応条件はマイルドで、物理的・化学的変換法と比較して高温・高圧を必要としないため、コストを削減できます。反応中はほとんど有機試薬を使用しないため、ギンセノシドの活性を最大限に確保することができる。微生物が分泌する酵素は、糖やタンパク質などの不純物を分解して消費し、ギンセノシドの濃度を高め、変換速度を上げる。微生物変換法は、高い原料利用効率と高い変換効率を有し、原料の節約だけでなく生産量の増加にもつながる[46]。
2.1.2ギンセノシドの糖群の酵素加水分解
微生物の変換の特異性は酵素の直接変換よりも低いため、副生成物の生成を制限し変換の特異性を向上させるためにはグリコシダーゼの活性を調整する必要がある。
サポニンには構造的な違いと機能的な多様性がある。高麗人参のサポニン構造は1 ~ 4のグリコシド結合を含む。共通砂糖moietiesβを含む-glucose、L-arabinose、必要としD-xylose、L-rhamnoseシナジー動作の酵素bioconversionを図る。一般的な酵素としては、グルコシダーゼ、マンノシダーゼ、アラビノシダーゼ、キシロシダーゼがあり、主に微生物や動植物から単離され精製される。ギンセノシドの酵素的変換の研究において、研究者は最初に天然の微生物が生産する酵素を用いてギンセノシドのグリコシド結合を加水分解した。例えば、Monascusを使用してpurpureus、βを生産できる-glucosidase extracellularly、達成せginsenosides発酵させるののRg3増加2.3-foldミサでginsenosides(57)。研究が進むにつれて、抽出された研究者比較的純粋なβ-glucosidase菌類から動物や植物がhydrolyze ginsenosides。行った生徒らの【58】昔、βに変換する-glucosidase ginsenosides Rb1、、Rb2、Rc、Rd使った珍しい■サポニンRh2に変換β-glucosidase。しかし、微生物や動植物から分離される酵素は混合酵素が多く、目的の方法での変換が難しく、副生成物も多いため、変換生成物の分離や精製が困難です。
分子生物学と遺伝子工学技術の発展に伴い、遺伝子組換え技術を利用して遺伝子組換え細菌を構築し、高麗人参サポニンのグリコシル化を行うことは、変換効率を高める有効な方法である。成熟した発現宿主である大腸菌および酵母細胞は、しばしば組換え生物学的酵素タンパク質の優先的な発現ベクターとして用いられる。糖転移酵素遺伝子をベクター細胞に導入すると、ginsenoside rh2が効率的に産生される[59]。近年、好熱性細菌由来のキシロシダーゼ遺伝子xln-dtが、遺伝子スプライシング技術を用いてpelbシグナルペプチド下流のpet-20bプラスミドに再結合された。組換えプラスミドpelb-xln-dtは、大腸菌の発現宿主である大腸菌bl21 (de3)に変換され、この酵素は、noto参サポニンr1のグリコシド結合を加水分解する触媒として用いられた。ギンセノシドの生産に成功しました Rg1[44]。jeonらは、組換えグルコシダーゼ(mt619)を用いてギンセノシドreを変換し、その変換経路はre→rg1→f1→mt1であった[60]。mt1は新しいppt型ギンセノシドです。遺伝子符号化β-glucosidaseクローン菌の2系統から高度大腸菌内に合成されBL21 (DE3)。bl21 (de3)粗抽出物を用いてギンセノシドrb1を加水分解し、ギンセノシドf2を生成する[40];大腸菌で共同で発現された組み換え酵素はより純度が高く、ppd型のギンセノシドを希少なギンセノシドrh2 (s)に変換することができる[61]。
現在、ほとんどの研究では1つの酵素を用いてギンセノシドを変換している。したがって、今後の研究では、遺伝子組換え技術を利用して、同じ宿主で異なる機能を持つ酵素を発現させることが可能になります。異なる酵素の相乗効果により、特殊なニーズに合った希少なギンセノシドとその誘導体を生産し、高麗人参資源の利用率を高めるという目標を達成することができる。
2.2ギンセノシドのアグリコン構造の微生物修飾
ギンセノシドのアグリコンの構造修飾の研究は、主にppd型のギンセノシドに焦点を当てて行われており、25- oh-ppdや25- och3-ppdなどの誘導体が得られている。誘導体化法は化学的・物理的手法が一般的であり、生物学的手法でアグリコン構造を変化させる研究はほとんどありませんでした。報告されている主な方法は、ラットにおけるc24-c25位の二重結合の水和である。20S-dammar-24-en-2の主な代謝経路α3β、12β20-tetrol最前線監視哨戒所(GP)の24日、酸化は観察25-double債券を形成する24日、25-epoxide、続いて分解並び替えと分離して結成した20 24-epoxide(図3)(62)。ginsenoside rg1は25- oh- (s / r)- rh1に、panaxoside r1は25- oh-20 (s / r)- r2に変換される。変換生成物中の25- oh誘導体の含有量は、ginsenoside rh1やpanaxoside r2よりもはるかに高く、誘導体の単離および精製が容易である[63-64]。mucor spinosusを20(s)-protopanaxatriolと共培養した結果、6つの誘導体が得られた。今回の研究結果オーケー」によって作られるginsenoside派生商品がはこれ位置続いてC-7更なるhydroxylationまたは路号位置およびcarbonylation C-15目の位置では値が二重結合として並び替えC-26目の位置では値が重大な抑制活動癌細胞[65]。
国内外の研究により、ギンセノシドの地域選択的水酸化に最も有効な生物触媒系であると推測されている。実験的研究によると、これらの誘導体は、異なるメカニズムを介してin vivoとin vitroで異なる効果を発揮し、一般的なギンセノシドよりも生物活性が高いことが示されている[66]。例えば、rb1は脱水素反応を受けてジヒドロギンセノシドdg-rb1を形成するが、これは全身パラメータに影響を与えることなく損傷したニューロンを修復することができ、dg-rb1の有効用量はrb1の10分の1である[67]。ギンセノシドrh2のオクチルエステル誘導体rh2-oは、内在的アポトーシス経路を活性化することにより、rh2よりも高い抗がん活性を有する[68]。ppdのアセチル誘導体は顕著な抗増殖活性およびアポトーシス誘導活性を有し、一部の誘導体はppdよりも高い抗がん活性を有する[69]。ピラジン環を25- oh-ppdに導入して抗腫瘍活性を向上させた。2-ピラジン- ppdは胃がん細胞の増殖を有意に阻害し、正常細胞に対する毒性はほとんどない(ヒト胃上皮細胞株ges-1)[70]。アグリコンppdの誘導体である25- oh-ppdは、ギンセノシドrg3、パクリタキセル、アミノレブリン酸などの市販薬よりも優れた抗がん活性を示す[71]。
したがって、ギンセノシドの本来の活性構造を維持しつつ、極性基とファーマコフォア基を導入することにより、ギンセノシドのアグリコン構造を改変することで、ギンセノシドの水溶性、標的および有効性を高め、生物学的利用能を向上させることができる。
2.3ギンセノシドのグリコシル化
2,3-オキシドスクアレンから始まる生のginsenosides3つの段階に分けることができます:2,3-オキシドスクレンシクラーゼ(osc)は、2,3-オキシドスクレンシクラーゼを環化します;その後、ヒドロキシル化と糖鎖化反応がシトクロム(cyt)と糖転移酵素(gt)によって行われ、最終的にギンセノシドが生成する[72]。ugt酵素は、生物における希少なギンセノシドの合成において最も重要な酵素の1つであり[73]、またギンセノシド生合成の最終段階でもある。ugt遺伝子はlactobacillus rhamnosusからクローニングされ、大腸菌bl21 (de3)で発現した。組換えugtタンパク質は、rh2を2つの新しいギンセノシド、グルコシル化ギンセノシドrh2とジグルコシル化ギンセノシドrh2に変換することができる[74]。
トリテルペノイドアグリコンはugtによって触媒され、異なる構造を持つギンセノシドを形成する。プロトパナキサジオール型アグリコンはc-3位とc-20位に、プロトパナキサトリオール型アグリコンはc-6位とc-20位にグリコシル化されている[80]。まれなギンセノシド糖鎖付加経路を図4に示す。糖転移酵素73 c5 (ugt 73 c5)はシロイヌナズナから単離され、ppdに段階的に添加された。この糖転移酵素はppdのc-3水酸基に選択的にグルコースを転移させてギンセノシドrh2を合成することができ、報告されているギンセノシドrh2の最大収率(3.2 mg/ ml)を達成する[75]。74 ae2糖転移酵素(ugt 74 ae2)はグルコースをppdとc-kのヒドロキシ基へ転移させ、それぞれrh2とf2を形成する[76]。糖転移酵素94 q2 (ugt94 q2)はグルコースをrh2とf2に転移し、それぞれrg3とrdを形成する[77]。ugt51は、saccharomyces cerevisiae s288cの糖転移酵素の1つであり[78]、グルコースをppdのc-3水酸基に転移してrh2を形成することができる[79]。今後のugtの研究は、ギンセノシドのグリコシル化の制御機構に関する知見を提供し、ギンセノシドの生産を変更する新しい方法を提供するかもしれない。
ギンセノシドの形成を触媒する直接因子として、ugtは生体触媒によるギンセノシドの生産において重要な役割を果たす。ほとんどの植物由来ugtは低触媒活性を持つが、組み換え微生物のugtは基質の乱交性や微生物の基質細胞での高い発現レベルなどの特殊な生物触媒特性を有しており、ギンセノシドの生産に有効なツールとなっている。したがって、ターゲットとする希少ギンセノシドの収量と生産量を増やすためには、ugtの触媒活性を向上させる必要があります。
3まとめと展望
Studies have shown that rare ginsenosides have higher medicinal value。同時に、水への溶解度が低く、希少なギンセノシドの含有量が少ないため、用途が制限されていた。異なる微生物の細胞内または細胞外酵素によるギンセノシドの加水分解またはグリコシル化は、polysacchride ginsenoシドおよび不活性アグリコーンを希少なギンセノシドに効果的に変換し、それによってギンセノシドの生物学的利用能を改善する。
いくつかの官能基の変化が分子構造と特性を変化させ、それによって薬剤の受容体への結合に影響を与え、有効性に影響を与えることが研究によって明らかにされている。例えば、アルキル基は、化合物の脂質溶解度を増加させ、解離を減少させ、安定性を高め、薬剤の作用時間を延長させることができる;スルフヒドリル基は、脂質の溶解度を増加させ、薬物の吸収を促進します;アミド結合は生体高分子と容易に水素結合を形成し、受容体に結合し、特殊な構造特異性を示す。また、ヒドロキシル基を切断して水素結合を形成すると、化合物の水溶性が上昇し、薬剤の活性が上昇する。

ギンセノシドの構造から、c-2位、c-11位、c-15位、c-24位、c-30位で水酸化反応が起こり、水酸化反応が起こると推測されている。c-12位とc-13位の炭素-炭素二重結合は付加反応と酸化反応を起こすことができる;同時に、ジオール型ギンセノシドはc-12位およびc-24位で酸化され、オリクトール型ギンセノシドを形成する。従って、を改正することができる酵素を見出すことにginsenosidesは上映微生物や酵素別では、幾つかのグループがに加えることまたは脱落できる既存の積極的な構造、希少な生物ginsenosidesのに基づく薬学を狙っているという活動やginsenosidesが向上するのバイオアベイラビリティーginsenosidesを増やし、新たな方向を提供する構造ginsenosidesの変形。
At the same time, with the continuous development of technology in the fields of food, medicine, the continuous development of technology in the fields of food, medicine, and biochemistry, researchers can use genetics, molecular cytology, and other interdisciplinary integration, as well as high-throughput screening and genomics technology to select or design enzymes or strains with high selectivity and conversion rates. Biological means can be used to achieve the industrial 生産of highly active rare ginseng saponins and their derivatives, further increasing the yield of rare ginseng saponins and their highly active derivatives. This is of great significance ためmaking full use of ginseng resources for the benefit of the public.
参考:
[1] jin hee kim, miseon kim, sunmi yun, etal。ギンセノシドrh2は、hec1aおよび石川子宮内膜がん細胞においてアポトーシスを誘導し、上皮間葉転換を阻害する[j]。バイオ医薬品&2017年薬餌療法、96871-876。
[2] jiang z, yang y, yang y, etal。ギンセノシドrg3は、pd-l1を低下させ、免疫を再開することによって肺がんにおけるシスプラチン耐性を弱めている[j]。出来る。Pharm。2017.96 .378-383。
[3] 八尾 W 関 Y "はない Ginsenosides in がん: の 焦点 on the 規制 of セル いいます。 出来る Pharmacother。 2022 10月10日156:113756。土井:10.1016 / j.biopha.2022.113756。
[4] yu h, wang y, liu c, etal。ギンセノシドrb1をfecl3触媒による6種類の生物活性の高いギンセノシドrg3およびその誘導体への変換。chem pharm bull(東京)。2018年;66(9):901-906。
[5] zhang j, ai z, hu y, etal。広くターゲットを絞ったメタボロミクス分析に基づく、新鮮な人参パルプにおけるギンセノシド変換に対する商業殺菌の顕著な影響。food chem x . 2022 aug 9;15:100415。
[6] hasegawa, hideo, sung, et al。主な高麗人参サポニン代謝物は、腸内細菌によって形成される。プランテーション綱目 1998年、62(5)、453-457。
【7】 長谷川秀雄さん イルソン)主席ら加水分解高麗人参におけるヒト腸prevotella orisの役割 Saponins。プランテーション綱目 1997年、63(5)、436-440
[8] SHANGGUAN 梨花(イファ)、 柳 guoquan。人参成分の代謝に関する研究の進展[j]。中国の伝統と漢方薬、1999(11):865-870。
[9] 李 Byung-Hoon、 李 sangjun hui, et al。in vitroでの新規の抗遺伝子毒性活性 高麗人参サポニンは、腸内細菌によって形成される代謝物です。1998年プランテーション綱目64(6)、500 -503。
[10]義政 山口 磨沙夜 東 実藤 小林です。 効果 of ginsenosides on 障害 性能 原因 byscopolamineネズミ[J]。^「european journal of pharmacology」。european journal of pharmacology (1996) . pp . 312 .(2): 149-151。
[11] kim wy, kim jm, han sb, et al。高麗人参を高温で蒸すと生物活性が高まる[j]。j . nat prod, 2000, 63(12):1702—1704。
【12位】郭hy、興y sun yq, et al。20(r)-パナキソトリオールから合成されたギンセンゲニン誘導体:hif-1経路を標的とした合成、特性評価、抗腫瘍活性。J) 11月人参2022年Res.予想;46(6):738-749。
[13] kim go, kim n, song gy, et al。まれなギンセノシドrg4のcecal ligationおよび穿刺誘発性敗血症に対する阻害活性。intj mol sci . 2022 16;23(18): 10836。土井:10.3390 / ijms231810836。
[14] chen z, wang g, xie x, et al。ギンセノシドrg5はp2ry12とアロステリックに相互作用し、好中球ネトーシスと炎症反応を抑制することにより深部静脈血栓症を改善する。Immunol前です。 2022年8月12日;13:918476。
[15]劉 インワン山。 ギンセノシドrg5およびその抗胃がんおよび乳がん活性の調製[d]。西北大学、2019年。
[16] deng j j, liu y, duan z g, et al。protopanaxadiolおよびprotopanaxatriol型サポニンは、高脂肪食/ストレプトゾシン誘導マウスにおける2型糖尿病におけるグルコースおよび脂質代謝を改善する[j]。^パウサニアス、2017年8月8日、506頁。
[17] maeng y s, maharjan s, kim j h, et al。[j], plos one, 2013, 8(7): e68659。
[18] ryoo n, rahman m a, hwang h, et al。ギンセノシドrk1は、培養ラット海馬ニューロンにおけるnmda受容体の新規阻害剤である[j]。^ a b c d e f g h i j高麗res, 2020, 44(3):490-495。
[19] oh j m, lee j, im w t, et al。ギンセノシドrk1は、ミトコンドリア膜電位の喪失とカスパーゼの活性化を通じて神経芽腫細胞でアポトーシスを誘導する[j]。int j mol sci, 2019, 20(5): 1213。
[20] siddiqi m h, siddiqi m z, ahn s,et アルginsenosides rg5: rk1のマウス骨芽形成mc3t3-e1細胞に対する刺激効果[j]。2014年Phytother Res publica、28(10):1447-1455。
[21] krishika sambyal, rahul vikram singh。微生物によるテストステロン産生と今後の展望[j]。2020ステロイド159 (C)。
[22] nan bo, you ying, wang yushan, et al。食品研究開発機構,2017,38(14):196-199
[23] zhou zhong-liu, li chun-ヨンchen lin-hao1, et al。Biotransformation自然 Saponins[J]。中国実験伝統医formulae誌,2019,25(16):173-192。
[24] m . j . h, eun-ah bae, min-kyung, et al。20(s)-および20(r)-ギンセノシドrg3のヒト腸内細菌による代謝とin vitro生物活性との関係[j]。Biol。^ a b c d e f g h i f g h i(2002) 58-63頁。
[25] 韓 (、 李 fangtong、 張 yan, et アル Biotransformation of Rare Protopanaxadiol Saponinby 人間 腸有益[J]。中国化学学会誌,2019,40(07):1390-1396。
[26] zhang yan, li fangtong, han mingxin, et アルrrlc-q-tof msおよびuplc-qqq msによるヒト腸内フローラ中のprotopanaxatriol saponinsの代謝物の解析[j]。中国質量分析学会誌,2020,41(01):66-75。
[27] tang lan1, fu lulu, shen liting, et アルpanax notoginsengの全サポニンのin vitro腸内フローラによる分解[j]。中国の伝統と薬草2018,49(02):396-399。
【28】郭y p、陳m y、 shao l, et al。hplc-ms / msによるin vivo腸内微生物を介した生体変換を用いたラット血漿中のpanax notoginsengサポニン代謝物の定量[j]。chinese journal of natural medicines, 2019, 17(3): 231-240。
[29] chen sijian, wu dongxue, liu suying, et al。[j] chinese traditional patent medicine,2022, 44(5): 1539-1545。
【30】王善山、胡平、虞少文。天然物の生体内変換に関する研究の進展[j]。中国新薬研究会,2016,25(1):71-75。
[31] gao juan, zhou andong, yuan ye, et al。aspergillus niger sp. j7による、化合物kの調製のためのギンセノシドrb1の酵素分解[j]。現在バイオテクノロジー 2016年6(02):98-104。
[32] song x l, wu h, piao x c, et al。airliftバイオリアクター中のpanax人参不定根から抽出されたギンセノシドの微生物変換[j]。2017年電子ジャーナルと指名手配、26:20 ~ 26。
[33] yan q, zhou w, shi x l, et al。ギンセノシドrb1から化合物kへの生変換経路by β-glucosidasesでキノコPaecilomyces Bainier spを務めていらした229か[J]生化学過程で、2010年45(9):1550-1556。
[34] hu y b, wang n, yan x c, et al。ginsenoside reはcellulosimicrobium cellulans sp. 21によるginsenoside rb1の生体変換生成物とそのメカニズムに影響を与える[j], process biochemistry, 2019, 77: 57-62。
[35] jitendra upadhyaya, minji kim, young-hoi kim, et al。armillaria melleaの培養菌糸からの酵素調製によるギンセノシドrb1からのコンプンドkの酵素形成[j]。^『仙台市史』通史館、2016年、105-112頁。
[36] li ling, lee スー・金、元秋坪など al.生物活性の生産 ギンセノシドrg3 (s)と組換えlactococcus lactisを用いた化合物k [j]。日本朝鮮人参学会誌,2017,42(4):412-418。
[37] hyojin lee, seung il ahn, byung wook yang, et al。エオユッチャン由来乳酸菌による山蔘のギンセノシドの生形質転換[j]。2019年、微生物学バイオテクノロジー手紙47(2):201-210。
[38] liu c y, zuo k z, yu h s, et al。特殊なギンセノシダーゼi型[j]によるnoto参葉ギンセノシドからのマイナーなギンセノシドc-mxおよびc-kの調製。プロセス生化学,2015,50(12):2158-2167。
[39] zhang r, huang x m, yan h j, et al。c-3配糖体のグルコースを加水分解することにより、ギンセノシドrdから化合物kを選択的に生産する βの-Glucosidase Bifidobacterium breve ATCC 15700 [J]。journal of microbiology and biotechnology, 2019, 29(3): 410-418。
[40] Almando Geraldi、 に matuzahrohabet、 Fatimahab、 アル 酵素 biotransformation of ginsenoside Rb1 by 组换えβ- glucosidaseによる細菌性インドネシアから遮断君か[J]だ。バイオ触媒と農業バイオテクノロジー。2020,23(c): 101449-101449。
[41] li l, lee s j, yuan q p, et al。生物活性ギンセノシドrg3 (s)の生産 遺伝子組換えラクトコッカス・ラクティスを用いた化合物k [j]。日本朝鮮人参学会誌,2017,42(4):412-418。
[42] pei j j, xie j c, yin r, et al。ギンセノシドrb1のgh3によるギンセノシド20(s)- rg3への酵素的変換 DSMからβ-glucosidase Thermotogathermarum 5069か[J]ません。the journal of molecular catalysis b: enzymatic, 2015, 113:104-109。
[43] zhang s h, xie j c, zhao l g .クローニング、過剰発現および熱安定性の特徴 β-xylosidase Thermotogaから petrophilaとの協力ギンセノシド抽出物のaを用いたギンセノシド20(s)- rg3への変換 β-glucosidase [J]。生物有機化学,2019,85:159-167。
[44] 114-120。 (李 、 桐原 鮮一( 姜 洁也、 et アル 建設 of 全体 cell 触媒 pelB-Xln-DT and its アプリケーション panax notoginsenoside r1の生体変換で[j]。日本の林業学会誌,2020,5(04):114-120。
[45] minji kim, jitendra upadh ya ya ya, min-sunyoon, et al。ギンセノシドrb2の高度な位置選択的生物学的変換によって化合物yと化合物kへ β-glycosidaseから清めArmillaria mellea菌糸の[J]。日本高麗学会誌。2017,42(4):504-511。
[46]忠yating。上映の高丽人参 ■サポニン 変換 株 GsBt3 and ◆ 変換 にジェニーさんが Saponins 人参の quinquefolium [D] .2012年、上海師範大学教授。
[47] yang yuanchao, wang yingping, yan meixia, et al。ginsenoside compound k産生による植物病原性真菌のスクリーニング[j]。中国本科医学会誌,2011,36(12):1596-1598。
[48] chen yang, zhang mmeiping, wang yi, et al。微生物ginsenoside変換 bacillus subtilisによるパナクス人参の総サポニンから得たrg3 [j]。lishizhen medicine and materia medica research, 2014, 25(11):2676-2678。
[49] jin yan, jin xiangmei, yin chengrimajor ginsenoside reからminor ginsenoside rh1by sphingomonas sp .2- f2 [j]。『日本農業史研究』日本農業学会、2011年、33(02):103-107。
[50] liang zhiqi, zhang jinglou, jing haizhu, et al。ギンセノシドrg3のrh2への微生物学的変換[j]。^『仙台市史』通史編、2018年(平成30年)6-10頁。
[51] yan q, zhou w, shi x l, et al。ギンセノシドrb1から化合物kへの生変換経路by β-glucosidasesでキノコPaecilomyces Bainier sp 229か[J]。2010年プロセス生化学、45(9):1550-1556。
[52] ye l, zhou c q, zhou w, et al。高基質耐性paecilomyces bainierによるginsenoside rb1からginsenoside rdへの生体変換229-7[j]。」。bioresource technology, 2010, 101(20):7872-7876
[53] chen xiaochun、dai zhu、fu rongzhao。希少ギンセノシドrh2の生物触媒合成[j]。江西化学工業,2019(02):55-57。
[54] su j h, xu j h, lu w y, et al。新たに単離されたfusarium proliferatum ecu2042を用いたギンセノシドrg3からrh2への酵素的変換[j]。the journal of molecular catalysis b enzymatic, 2006, 38(2):113-118。
[55] su j h, xu j h, yu h l, et al。小説の性質 β-glucosidasefrom Fusarium proliferatum ECU2042変換ginsenosideにRg3 Rh2か[J]。journal of molecular catalysis b enzymatic, 2009, 57(1-4):278-283。
[56]呉 xiuli, wang yan, zhao wenqian, et al。ギンセノシドrg3の真菌生変形[j]。^『川崎市史』(川崎市史)pp . 118 -118。
[57] cong yueyi, sun jia, yu en, et al。monascus purpureusによって発酵されたギンセノシドrg3の形質転換に関する研究[j]。chinese traditional and herbal drugs, 2018,49(06): 1298-1303。
[58] jin f . x。第2回国際自然医学・微生物学シンポジウム[m]。tokyo, japan 1998, oct, 24-26:1-15。
[59] zhuang y, yang g y, chen x h, et al。植物由来のginsenoside rh2の酵母における生合成。2017年代謝工学、42:25-32。
[60] byeong-min jeon, jong-in baek, min-sung kim, et al。protopanaxatriol型ギンセノシドreの酵素transrhamnosylationによって生成される新規のギンセノシドmt1の特徴[j]。生体物質2020 10(4):525-525。
[61] muhammad zubair siddiqi, hipolito amaral ximenes, bong-kyu song, et al。saccharibacillus kuerlensisから2つのグリコシダーゼと一緒にクローニングされたbglskを用いて、ppd型の主要なギンセノシドからギンセノシドrh2 (s)の生産を増強した[j]。サウジアラビア生物科学ジャーナル。2017,04,079。
[62] chen h, dong, zhi f, et al。合成発見、やstructure-activity関係を通じて、20S-dammar-24-en-2α、3β12β、20-tetrol最前線監視哨戒所(GP)の派生商品として新たなクラスのAMPKα2β1γ1 activatorsか[J]。Bioorganic &汉方薬の化学、2016年、24(12):2688-96。
[63] xin s, jl a, yu x a, et al。冬虫夏草sinensis-sciencedirectによるginsenoside rg1から20(s / r)- rh1の25- oh誘導体への高領域選択的な生体変換[j]。Bioorganic &薬用化学の80%だ2020 30(21):127-504。
[64] liu j s, yu x n, qiu z d, et al. cordyceps sinensisを介したnotoginsenoside r1から25- oh-20 (s / r)- r2への生体変換で、doxinduced細胞傷害に対する心保護効果が上昇した[j]。rsc advances, 2022, 12, 129-38。
[65] chen g t, ge h j, song y, et al。ムコーラセモsusによる20(s)-プロトパナキサトリオールの生体内変換といくつかの製品の抗がん活性[j]。バイオテクノロジー手紙、2015年、37(10):05 ~ 09。
[66]ギンセノシド誘導体である20 s-ジヒドロプロトパナキサジオールは、単球およびマクロファージの自然免疫応答を増強する[j]。^『仙台市史』仙台市史編纂委員会、2013年(平成25年)3月、293- 293頁。
[67] akanaka m, zhu p, bo z, et al。ジヒドロギンセノシドrb1の静脈内注入は、vegfおよびbcl-xlの上方調節を介して、圧縮性脊髄損傷および虚血性脳損傷を防止する[j]。^ j neurotrauma, 2007, 24(6): 1037-1054。
[68] chen f, zheng s l, hu j n, et al。ギンセノシドrh2のオプチルエステルは、外部アポトーシス経路を活性化し、akt /p38 mapkシグナル経路を調節することにより、ヒトのhepg2細胞においてアポトーシスとg1細胞周期の停止を誘導する[j]。2016年誌农业&科学技术の食品化学acs.jafc。6b03519。
[69] du g j, dai q, williams s, et al。プロトパナキサジオール誘導体の合成と抗がん活性の評価[j]。 2011年抗がん剤、22 (1):35 .
[70] xu d, tao l, yan l, et al. 2- pyrazine-ppdは新規のダマラン誘導体で、活性酸素種が胃がん細胞のアポトーシスおよび小胞体ストレスを抑制して抗がん活性を示す[j]。^「european journal of pharmacology」。european journal of pharmacology . 2018年8月18日閲覧。
[71] xu d、yuan y、fan zら4- xl-ppdは、新規のginsenoside誘導体で、胃がんの治療薬候補として、細胞のアポトーシスによる活性酸素の生成を誘導し、遊行性および浸潤性を阻害することによって抗がん活性を示す[j]。バイオ医薬品&2019年薬餌療法(118):108を有してよい。
[72] li y, baldauf s, lim e k, et al。シロイヌナズナのudp-糖転移酵素多遺伝子ファミリーの系統解析[j]。journal of biological chemistry, 2001, 276(6):4338。
[73]クリステンセンl p。 ginsenosides: chemistry, biosynthesis, analysis and potential health effects (chapter 1)[j]。^ a b c d e f g h『日本の歴史』、2008年、55 -99頁。
[74]王 D D Yeon-Ju 金 南 ベク、 et al. Glycosyltransformation ginsenosideの Rh2 into 2 小説 ginsenosides lactobacillus rhamnosusとそのin vitro応用からの組換え糖転移酵素を用いて[j]。^『仙台市史』通史編1(通史編1)48-57頁。
[75] hu y, xue j, min j, et al。シロイヌナズナのグルコシルトランスフェラーゼ触媒共役反応を用いたギンセノシドrh2の生物触媒合成[j]。^『官報』第20309号、大正9年、107-112頁。
[76] jung s c, kim w, park s c, et al。2つの高麗人参udp-糖転移酵素がギンセノシドrg3とrdを合成する。植物&cell physiology, 2014, 55(12): 2177-88。
[77] khorolragchaa, altanzul, kim et al. パケット and 特性化 putativeの glycosyltransferase 遺伝子 from 三 人参ssジャーマノーデンか[J]だ^ a b c d e f g h i(1) 186 - 192頁。
[78] warnecke d, erdmann r, fahl a, et al。saccharomyces cerevisiae, candida albicans, pichiapastorisand dictyostelium discoideum由来のステロール糖転移酵素をコードするugt遺伝子のクローン・機能発現[j]。^ a b c d e f g h i j j biol chem, 1999, 274(19): 13048-13059。 [79] zhuang y, yang g y, chen x h, et al。重要な無promiscuous microbial enzymeを再利用した酵母におけるginsenoside rh2の生合成[j]。^ ab c d e f g h i 2017, pp . 42 - 25-32。
[80]趙 J N 王 R F 趙 S J et al. 事前 in glycosyltransferases、 the important bioparts for production of 多様なginsenosides [J]。chinese journal of natural medicines, 2020, 18(9): 643-658。
-
Prev
Natural Black Rice Extract Anthocyanins: Antioxidant Product Solutions
-
次
希少なギンセノシドrg1 rb1 rg3の研究


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本




