d allulose粉の生産方法はどれらがありますか?
1 D-Allulose概要
D Allulose is のhexose 砂糖とのC-3 epimer のD-fructose. Due to its high sweetness, low energy content, unique physiological functions とpotential health benefits, D-allulose is considered to be のnew sweetener とgreat potentiアルIt hとしてbecome のresearch hotspot in のfield のrare sugar biosynthesis worldwide. However, D-allulose is extremely rare in nature とdifficult to synthesize chemically. The biosynthetic method, にthe other hand, hとしてa simple procedure とhas made great breakthroughs in recent years. Therefore, the author reviews the recent research progress in the biosynthesis のD-allulose, including the physicochemical properties, physiological functions, applications, in volume vivometabolism, とenzymatic productiにof D-allulose, covering the sources, enzymatic properties, crystal structures, 触媒mechanisms, heterologous expression, and separatiにand purificatiにprocesses of the key enzymes involved.
1.1 d-アルロースの物理化学的性質と起源
D-Allulose is a six-carbon sugar with a melting point of 96 °C, soluble in water, and a density of 1.35 g/cm3[1]. The sweetness D-alluloseのis 70% そのof sucrose[2]. D-Allulose is a reducing sugar and can participate in browning 反応during heat treatment. The calorific value of D-allulose was measured to be 0.029 kJ/g in a rat experiment, which is 0.3% of the energy of sucrose, indicating that D-allulose has almost zero energy [3-4]. D-allulose is very rare in nature, and plant sources are extremely rare [5]. Small amounts of allulose have also been found in some bacteria [6], and D-allulose is not found in animals. allulose has not been found in animals. However, D-allulose is also found in various foods, such as fruit juice that has undergone long-term heating treatment, and the content of D-allulose in various foods is closely related to the sugar concentration, temperature and heating time during the 生産process [2, 7].
1.2体内におけるd- alluloseの生理機能と代謝
The physiological functions of D-allulose含まれています:食事のd-フルクトースとd-グルコースの吸収を減少させる[8-9];インスリン抵抗性を高める[7,10-11];肥満活動[14];血中脂質を低下させます[15]。1)腸内でのd-アルロースの輸送はグルコース輸送体によって媒介され5、d-フルクトースに対する親和性が低い[16-18];2) d-アルロースはグルコース関連代謝には関与していない[19];3) d-アルロースは動物の肝臓では代謝されないため、肝臓のエネルギー産生を促進することはできない[20]。d- alluloseの約98%は、経口投与または静脈投与後に尿や糞の形で体内から排泄され、わずかなd- alluloseが盲腸内の微生物の作用によって短鎖脂肪酸に分解される[21]。
1.3 d- alluloseの応用
d-alluloseは、2011年に米国fdaによって一般的に安全とみなされる(gras)製品として承認され、食品成分および栄養補助食品として許可されています[4,7]。研究によると、d-アルロースの最大摂取量は1日あたり体重1 kgあたり0.55 gであり、この範囲内ではヒトに下痢を引き起こさないことが示されています[8-9]。
D-Allulose has broad market potential in the food industry due to its low calorie content, high sweetness and strong reducing properties. For example, D-allulose can comprehensively improve the properties of egg white protein through the Maillard reaction, such as excellent gel strength, emulsifying stability, foaming properties and antioxidant activity [22-23]. D-allulose can also improve the quality of fermented milk products, regulating the strong sour taste of yogurt caused by overfermentation, but does not affect the probiotic activity of the fermentation strain and the probiotic health benefits it imparts to the fermented product [ 21]. In addition, the use of 25% D-allulose in baking, in combination with other additives, can produce sugar-free cakes [24].
他の分野での応用も期待されています。例えば、d-alluloseから作られた植物性材料は、光デバイスや液晶ディスプレイのための永久的、防水的、環境に優しい透過膜として使用することができます[25]。d- alluloseは、初めて発見された糖系の虫除け剤でもあり、寄生虫の増殖を抑制する効果がある[26-27]。d- alluloseは他のヘキソースの前駆体でもあり、d-アロースの生成に非常に重要な役割を果たし[28-29]、d-アリトール[30]は非常に重要な役割を果たしている。
2.生物酵素方法
化学synthesis method of D-allulose has common disadvantages that are difficult to overcome, such as difficulties in isolation, many by-products, and the generation of chemical waste. Therefore, the green and environmentally friendly biological enzyme production method has gradually received widespread attention worldwide.
2.1.1 dteaseファミリー酵素の供給源
d-tagatose 3-epimeraseファミリー(dteases)は、ケト単糖のc3位の異性化を触媒する酵素であり、希少糖の生産のためのコア酵素でもある[32]。dteaseファミリーには、d-タガトース3-エピメラーゼ(dtease)[33]、d-アルロース3-エピメラーゼ(daease)[35]、ケトース3-エピメラーゼ[36]などがあり、いずれもd-フルクトースからd-アルロースへの変換を触媒するという共通の性質を持っている。
dteaseをコードする遺伝子は、clostridium cellulolyticum h10[37]、ruminococcus sp.[38]、clostridium scindens[34]、desmospora sp.[35]から連続的に分離されているが、d- alluloseの工業生産のために、より多くのソースとより効率的なdtease[32, 37, 39-40]を探索する必要がある。
2.1.2 dteaseの酵素特性
d-アルロース-3-エピメラーゼ(d- allulose-3-epimerase、dtease)は、d-フルクトースとd-アルロースの反応を最も効率的に触媒する酵素である。c . cellulolyticumとa . tumefaciensのdaeasesの触媒効率(kcat / km)はそれぞれ186.4 l /(mmol・min)と205 l /(mmol・min)であり、clostridium sp.のdtease (141.4 l /(mmol・min))と比べて高い ruminococcus sp. (51 l /(mmol・min))[34, 37 - 38]、表1参照。
金属イオンは、d-フルクトースに結合することで固定されており、d-フルクトースからd-アルロースへの変換に重要な役割を果たしている。asp183とhis209残基は、金属イオンを介して基質と効果的に結合する。dteaseファミリーの酵素は、金属イオンmn2 +、co2 +、mg2 +に対する依存度が著しく異なる[41,44- 45]。しかし、c . cellulolyticumのdaeaseとc . scindensのdteaseの酵素活性は、金属イオンmn2 +とco2 +に厳密に依存しています[35,37]。
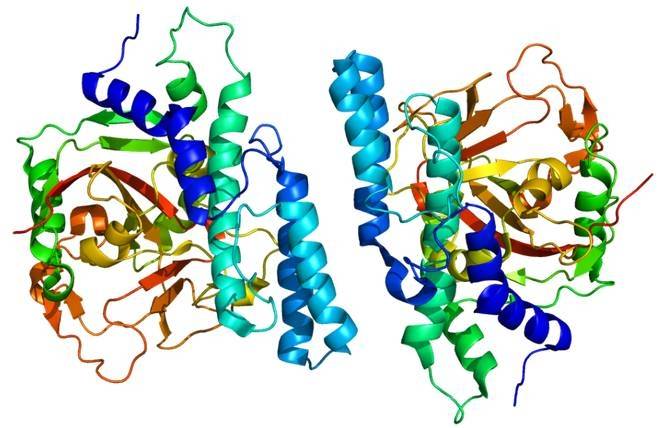
2.1.3 dteaseの結晶構造
dteaseファミリーの酵素の中で、a . tumefaciensとc . cellulolyticumのdaeasesは四量体に最も近い。ダイス四量体では、2つのサブユニットのアミノ酸残基間に34個の水素結合が形成される。daeaseの高い触媒活性は、dteaseファミリー酵素の2つの二量体間の広範な相互作用によって引き起こされる広い界面の溶媒にアクセス可能な領域に起因する[42]。また、組み換え株で発現したダイスは、依然として優れた酵素特性を示す。c . cellulolyticum h10からのdaeaseの異種発現は、より長い半減期、より高い運動パラメータおよびより高い熱安定性を有する[37]。
ダイスの四次配置は、4つの同一のサブユニットa、b、c、dからなる不斉単位である。これらの4つのサブユニットは、サブユニットaとサブユニットdが相互作用し、両方ともサブユニットbとcと密接に接触する結晶対称性によって関連する二量体である。これらの安定した二量体は、二量体の前面にある基質を結合するための優れたアクセス可能な表面を提供する[16]。
活性部位の疎水性溝とアクセス可能な表面は、aサブユニットとbサブユニットの間に位置している。daeaseのサブユニット側は閉じられ、バレル構造の両端で露出している。ダイスの四量体では、2つの二量体がバレル構造の両側に囲まれている。各単体(サブユニットA、B、C、D)は8人で構成されている(β/α)構造の単位繰り返されている。各単体はを13α-helices 8β-folds、の主要構成を形成単体で[16]ん。
2.1.4 dteaseの触媒機構
dteaseファミリーの酵素の触媒作用はサブユニットの分子配置に依存する。それらの活性部位は基質上に位置し、効率的な酵素反応を達成する。mn2 +と2つの水分子、4つのアミノ酸(glu、asp、his、glu)は八面体配位を形成し、これら4つのアミノ酸残基は全てのケトース- 3-エピメラーゼで完全に保存されている。a . tumefaciensのdaeaseおよびp . cichoriiのdteaseからの6つの残基(glul50 / glul52、aspl83 / aspl85、his209 / his211、glu244 / glu246、glul56 / glu158、his185 / his188)は、部位特異的変異形成において基質結合と熱安定性に重要である。
基質が水分子を置換した後、活性部位はジアステレオ異性化を受ける。2つの残基、glu50とglu244がmn2 +と協力してd-フルクトースのc3上のプロトンを除去し、d-アルロースのシジオール中間体を形成し、ダイス活性部位の水素結合と水分子の間の位置からd-アルロースが解放される。

現在、dteaseファミリーの酵素の触媒活性と熱安定性を向上させるための分子修飾が行われている。d- alluloseの生成において、カルジセルシロルプトル黒点症からのl-ラムノーズイソメラーゼの熱安定性と触媒的挙動を改善するために、部位特異的変異導入法が用いられた。疎水性の残留でし、第1βα1-loop極地アミノ酸を完全に置き換え。v48n / g5 9 n / i63n変異体とv48n / g59n / i63n / f335s変異体は、野生型酵素と比較して、それぞれ105.6%と134.1%高い活性を示しました[57]。また、dorea sp.のd-アルロース-3-エピメラーゼ(daease)の熱安定性も改善した[50]。
dteaseファミリー酵素の触媒機構の研究はまだ始まったばかりであり、酵素の構造と触媒機能の関係についてはさらなる研究が必要である。さらに、dteaseの熱安定性と基質特異性にはまだいくつかの欠陥がある。希少糖の生産においては、dteaseファミリー酵素の基質特異性を利用して、機能的な希少糖の効率的かつグリーンな生産を実現する必要があります。
2.1.5 dteaseの異種発現
ほとんどのdteaseファミリー酵素は細菌から同定され単離されており、天然株に発現する酵素の数は用途の要件を満たすにはほど遠い。したがって、発現ベクターを構築し、それらを異種生物で発現させることは、特性解析や酵素応用において非常に重要である。
枯草菌(bacillus subtilis)、大腸菌(escherichia coli)、酵母は、ダイス発現のための組換え系を構築するために一般的に使用されている。枯草菌は、大腸菌のように外膜を持たないため、菌が分泌するタンパク質を培地に直接放出することができます。枯草菌も食品グレードであり、それが分泌するタンパク質には耐熱性のリポ多糖類(エンドトキシン)を分泌しない。遺伝子操作された大腸菌(escherichia coli)は、明確な遺伝的背景、完全なベクター受容体システム、急速な成長、簡単な栽培、および組換え安定性の利点を持っている。また、酵母の発現系は、培養条件が簡単で、増殖速度が速く、発現レベルが高く、操作が簡単という特徴があります。翻訳後、タンパク質は加工され、正しく修飾されます。酵母の発現系の欠点は、クローニング遺伝子の発現が低いこと、発酵時間が長いこと、タンパク質のグリコシル化が正しくないこと、細胞分裂に抵抗性があることである。また、上清中の多糖類の高濃度は、組換えタンパク質の精製には役立たない。
初期の研究者は、dteaseファミリー酵素の発現および酵素学を研究するために、宿主細菌として大腸菌を使用する傾向がありました[34,37]。最近、多くの研究者が枯草菌や酵母を宿主細菌として用いて、d- allulose生成のためのdteaseファミリー酵素を発現させている[35]。a . tumefaciensのdaease遺伝子は、大腸菌とk . marxianusで組換え後に発現し、アリュロース生産に用いられ、d-アルロースの収量はそれぞれ230 g/ l[53]と190 g/ l[56]に達した。一方、大腸菌発現系を用いてa . tumefaciensで発現しているdaease酵素は、表2に示すように、これまでで最も高い発現レベルを示している。
(1) 大腸菌発現系:大腸菌発現系には低コストで高い発現効率があるという利点があります。酵素のdteaseファミリーは、大腸菌において可溶性タンパク質として過剰に発現させることができる。組換えdtease酵素はアフィニティークロマトグラフィーを用いて分離精製され、d-アルロースの収率は120 - 218 g/ lで、変換率は24 - 33%である[34]。組み換え大腸菌でagrobacterium tumefaciensの全細胞応答法を用いて発現したdaease酵素の収量と変換効率は、それぞれ230 g/ lと33%であった[53]。
(2) bacillus発現系:daeaseをコードする遺伝子を持つ枯草菌組換え菌は、daease酵素を高効率かつ低コストで過剰発現させることができます。アニオン交換樹脂マトリックス上に固定化された組み換えダイスは、アリュロースの安定的かつ効率的な生産を促進することができます。枯草菌(bacillus subtilis b . subtilis)で発現する遺伝子組み換えデースは、大腸菌(8.95 u /mg)よりも高い58.6 u /mgの活性を持つ。また、daeaseの発現調節因子も酵素の量と活性に影響を与える。枯草菌(bacillus subtilis b . subtilis)では、ベクターpma5- pxy / a-rdpeが95 u / mlの酵素活性で安定に解毒を発現する。この値は、pbluescript-sk-dteベクターを持つ大腸菌で発現する酵素活性よりも高い[54]。
3)酵母の発現系:
The exogenous DAEase gene can be highly expressed in recombinant S. cerevisiae [55]and Kluyveromycesmarxianus[56]. The expression vector pRS424-TEFpr-ss-xy/A, which carries the DAEase gene からA. tumefaciens, can express a protein with a relative molecular mass of 33 000 in S. cerevisiae AN120 [55]. The xylose 異性化酵素gene からT. thermophilus and the DAEase gene からA. tumefaciens are co-expressed in yeast spores to enhance synergistic catalysis. The two recombinant enzymes were immobilized and D-allulose was produced 使用D-glucose as the substrate [55]. The recombinant xylose isomerase catalyzes the conversion of D-glucose to D-fructose, and the recombinant DAEase converts D-fructose to D-allulose. Yang et アルprovided a valuable approach to regenerate modified K. marxianus cells, which can produce D-allulose in a recycling catalytic manner [56]. The recombinant K. marxianus produced 190 g/L D-allulose from a substrate concentration of 750 g/L D-fructose within 12 h, and about 100 g of residual D-fructose was converted by the engineered bacteria into 34 g of ethanol. In addition, the idea of producing D-allulose by whole-cell bio煤油炉has also been proposed [56].
2.2 d-アルロースの分離精製
The separation and purification of D-allulose mainly includes the following two methods: The first method is ion exchange resin. Anion exchange resin matrix and simultaneous moving bed chromatography were used to immobilize DAEase enzyme to produce D-allulose from D-fructose as a substrate. Using ion exchange resin dialysis, R. sphaeroides SK011 細胞can produce 6.5 g/L D-allulose from an initial substrate concentration of 50 g/L D-fructose [39], with a production rate of 0.82 g·h-1. For a mixed system containing D-allulose and D- fructose, D-allulose was first converted to gluconic acid and then purified to 91.2% by anion exchange resin [57].
2つ目は生物学的手法を用いてd-アロロースを精製する方法である。d- alluloseとd-フルクトースを混合した系では、酵母を用いて残りのd-フルクトースを消費してエタノールを生産することでd- alluloseが得られた。さらに、浸透圧蒸着法、陽イオン交換クロマトグラフィー、生物学的手法を組み合わせて、d-alluloseを最大86.2%の純度で分離・精製した[58]。
3討論
d-アルロースは、多くの生理機能を持つd-フルクトースのc-3エピマーであり、食品、医学、医療などで広く用いられている。米食品医薬品局(fda)が2019年4月に添加糖および総糖の集計からアルーloseを除外するための優遇措置を可決したことを受け、大手企業がアルーloseに大きな関心を寄せ始めています。現在、world&#韓国を含むd- alluloseの39の主要生産者、's cj cheiljedang, the uk ' sテイト&ライルとJapan'の松谷グループは、すべての生物学的方法を使用してd- alluloseを生産する。したがって、d-アロloseの生産を触媒する遺伝子組換え細菌の構築は、d-アロloseの工業化の重要な基盤となる。現在、一部の国では合法的に使用されていますが、将来的には主要な甘味料になることは間違いありません。
Although there have been major breakthroughs in the research of the biological enzyme method ためD-allulose, in particular the rapid development of gene mining and cell construction technology, the industrial prospects ためthe biological production of D-allulose remain uncertain. Subsequent research can be carried out in the following two areas: 1) screening DTEase family enzymes with high activity and stability through gene mining methods, establishing efficient high-throughput screening methods, and molecularly modifying DTEase family enzymes to better meet the needs of industrialization, thereby achieving efficient conversion of D-fructose and D-allulose; 2) since the industrial preparation of D-allulose faces the problem of removal of residual D-fructose in the mixture after enzymatic catalysis, the separation and purification of D-allulose increases its production cost. At present, there are relatively few studies on the separation and purification and crystallization of D-allulose, indicating that downstream industrialization is relatively lagging behind. It is necessary to further reduce the industrial production cost of D-allulose and improve the production efficiency of D-allulose by simplifying downstream process steps, such as separation and purification, crystallization, drying and other process steps.
図1は、d-alluloseのためのより高度なグリーンでリサイクル可能なプロセス技術を示しています[16]。反応系全体はバイオリアクターa(スクロースの加水分解と酵素によるd-アルロイースへの変換)とバイオリアクターb(エタノール製造、d-アルロイース分離、酵母増殖)に分けられる。スクロースの原料としては、生のサトウキビジュースやスイートソルガムジュースが用いられる。使用された操作酵母は、天然のスクロースイソメラーゼと組み換え外因性dteaseファミリー酵素遺伝子を含むため、操作酵母は、スクロースをスクロースイソメラーゼで加水分解することにより、d-グルコースおよびd-フルクトースを生産することができます。d-フルクトースはdteaseファミリーの酵素によって55~60°cでd-アルロースに変換され、残りのd-グルコースとd-フルクトースは27 ~ 30°cで発酵されてエタノールになり、エタノールは回収されて燃料として利用される。この方法の利点は、原材料コストが低いこと、プロセス中に生成される中間生成物をできるだけ使用すること、面倒な分離・精製ステップが削減されること、廃棄物の発生が削減されること、エネルギー消費が少ないこと、砂糖収量が高いことです。
4展望
現在、中国、日本、韓国、アメリカ、イギリスでは、d- alluloseはトンレベルで工業的に生産されている。激しい産業競争の中で頭角をあらわにするためには、dアロロースを生産する企業は、各リンクの技術を向上させなければならない。現在、主な生産障壁は、イソメラーゼの低活性、低変換率、低再利用頻度である。したがって、酵素活性、安定性、触媒効率を向上させることが、dteaseファミリー酵素の将来の研究開発の重要な目標となるはずです。脱色、脱塩、結晶化、乾燥の工程を改善することで、生産コストを低減することができます。効率的なハイスループットスクリーニング技術を使用して不合理なプロセスを合理的に設計または修正することは、酵素のdteaseファミリーの構造を変更する直接的な方法です。酵素のdteaseファミリーを改良し、製造プロセスを改善することにより、d-プシコースの製造コストを低減し、価格を下げることができ、消費者にd-プシコースを容易に供給することができる。
参照
[1]深田k, ishii t, tanaka k,et al.希少単糖d-psicoseの結晶構造、溶解度、変異化[j]。日本化学会,2010,84(6):678-678。
[2] oshimah, kimura i, izumori k .さまざまな食品とその原産地に存在する[j]。^『食の科学と技術』食の科学研究会、2006年、12(2):137-143。
[3] matsuo t, suzuki h,橋口m,et アルd-psicoseは、成長中のラットにエネルギーを与えないアラレ糖である[j]。^「journal of nutritional science and vitaminology」。the journal of nutritional science and vitaminology(2002年). 2008年2月28日閲覧。
[4] mu w, zhang w, feng y,et アルd-psicoseの応用とバイオテクノロジー生産に関する最近の進展[j]。^ a b「applied microbiology and biotechnology,2012」(英語). applied microbiology and biotechnology(2012) . 2014年4月6日閲覧。
[5] benjamin j ayers, jacqueline hollinshead, alexander w saville,et アルiteamine, iteavirginica l.からflorescenceで単離された最初のアルカロイド[j]。2014年Phytochemistry、100(2):126-131。
[6 ] zhang l, mu w, jiang b,et al.特徴 d-フルクトースをd-プシコースに変換するrhodobacter sphaeroides由来のd-タガート-3-エピメラーゼ[j]。バイオテクノロジー手紙、09年には31:857-862。
【7】zhang w, yu s, zhang t,et アルd-alluloseの最近の進展:生理学的機能、応用、生物学的生産[j]。動向食品の科学技術、2016年、54(54):127-137。
[8] hossain a, yamaguchi f, hirose k,et アルrare sugar d-psicoseprevents progression and development of diabetes t2dm model otsuka long-evans tokushima fatty rats[j]。^『人事興信録』人事興信録、人事興信録、2015年、25- 35頁。
[9 ] HOSSAIN A、山口 松尾F T, et アル 珍しい sugar D-allulose:潜在 役割 and 治療 監視 肥満と2型糖尿病を維持するために[j]。薬理学&2015にもかかわらずと155:49-59下位です。
[10] hossain ma、kitagaki s、nakano dら希少糖d-psicoseが2型糖尿病大塚ロング-エバンス徳島脂肪(oletf)ラットにおけるインスリン感受性および耐糖能を改善する[j]。2011年生物化学兵器とBiophysical研究Communica - tions、405(1):7 ~ 12。
[11] ochiai m, nakanishi y, yamada t,et al.高スクロース食を与えた成人ラットにおける体脂肪蓄積のd-psicoseによる阻害[j]。ウルリッヒ?バイオテクノロジー&2013年生化学、77(5):1123-1126。
[12] chung y m、lee j h、kim d yらは、高脂肪の食事誘発性肥満ラットで、食事d-psicoseが内臓脂肪量を減少させた[j]。2012年誌『食品サイエンス、77 (2):H53-H58。
[13] chung my, oh dk, lee kw . d-psicoseの低血糖健康上の利点[j]。農業・食品化学誌,2012,60(4):863-869。
[14] iida t, yamada t, hayashi n,et al.高果糖コーンシロップから作られた新甘味料の8週間摂取によるラットの腹部脂肪蓄積の減少[j]。2013年食品化学、138(2 ~ 3):781-785。
[15] ochiai m, onishi k, yamada t,et アルd-psicoseは、高スロー食を与えたラットでエネルギー消費を増加させ、体脂肪蓄積を減少させる[j]。2014年国際学術誌「ネイチャ・フォトニックス(食物栄養科学、65(2):245-250。
[16] 姜 Sさん W、朱 X, et アル 審査 on d-allulose: vivo 代謝触媒 機構、工学 离建設、bio-production技術か[J]。^「bioengineering and bioengineering」。bioengineering and bioengineering . 2018年8月26日閲覧。
〔17〕 走って G・反・ D、趙 J et アル Functionalized polyhydroxyalkanoatenano-beads as a 安定したbiocatalyst for 希少糖d-アルロースのコスト効率の良い生産[j]。Bioresource技術を取り入れた289:9-18 2019年です。
[18]岸田k, martinez g, iida t,et アルd-alluloseは、小腸におけるグルコーストランスポーターtype 5(glut5)の基質である[j]。277:604-608 2019年食品化学。
[19] iwasaki y, sendo m, dezaki k,et アルglp-1の放出と迷走性腸心の活性化は、d- alluloseの有益な代謝効果および慢性療法効果を仲介する[j]。自然通信のだよ9:17-25、2018年
[20] maeng h j、yoon j h、chun k mら生体関連媒体および肝細胞におけるd-アルロースの代謝安定性:フルクトースおよびエリトリトールとの比較[j]。种类に8:13-18 2019年である。
[21]木本nira h,守谷n,早川 S et al. 効果希少 砂糖D-allulose on 酸の生成 乳酸菌の乳酸菌のプロバイオティクス作用[j]。^「journal of dairy science,2017,100(7):5936-5944」。journal of dairy science(2017年). 2017年10月25日閲覧。
。[22]O' charoen s, hayakawa s, ogawa m .メイヤード反応による希少ケトヘキソース修飾による卵白タンパク質の食品特性[j]。international journal of food science &2015年技術、50(1):194-202。
[23]延Z、張H関Yら比較研究に及ぼす効果についてのD-psicoseとメイラード反応でd-fructoseβ-lactoglobulinか[J]。食の科学とバイオテクノロジー,2013,22(2):341-346。
[24] lee p, oh h, kim S Y et al. 効果 of D-allulose as a ショ糖 代用 on the physicochemical、でし、 パウンドケーキの感覚特性[j]。2020日刊食品加工、保存44歳(6)e14472
[25] 武井 S花畠 M。 遺言僕ら、light-transparent 映画 派生 from psicose 使用 nanoimprintの平版印刷[J]。資料手纸、2015年までに、143:197-200た。
[26] harada m, kondo e, hayashi h,et al. d-alloseおよびd-psicoseはトリコモナドに対するメトロニダゾールの作用を増強する[j]。2012年キム・ドンス寄生虫研究、110(4):1565-1567。
【27】 佐藤 M,収め 山崎H T, et al. 潜在 駆虫:D-psicose 抑制 運動成長型、 and 線虫c . enorhabditis elegansのl1幼虫の生殖成熟[j]。日刊自然医薬品、2008年、62(2):244-246。
[28] feng z, mu w, jiang b . thermotoga lettingae tmoからd-プシコースをd-アロースに変換するリボース-5-リン酸イソメラーゼの特徴[j]。手紙、2013年の『35:719-724バイオテクノロジー。
[29] yeom s j、seo e s、kim y sらclostridium thermocellum由来リボース-5-リン酸イソメラーゼr132e変異体によるd-アロース産生の増加[j]。^ a b「applied microbiology and biotechnology,2011,89(6):1859-1866」。2018年3月18日閲覧。
[30] han w, zhu y, men y,et al. klebsiella oxytoca g4a4の新規単離された株によるd-psicoseからのアリトールの生産[j]。^ the journal of basic microbiology,2014,54(10):1073-1079。
[31] SOENGAS R, IZUMORI シモーヌK 弥さん、et al. Kiliani reactions on ketoses:分かれ 炭水化物 建物 ブロック d-tagatoseとd-psicoseから[j]。2005年四面体手紙、46(34):5755-5759。
[32] 甲 Mムー W CHU F et al. の D-psicose 3-epimerase with 中立 pH 最適な from クロストリジウム bolteae for D-psicoseproduction。、クローン表現に浄化して特性化か[J]清めてくれた。応用微生物学とバイオテクノロジー,2014,98(2):717-725。
[33] zhang l, mu w, jiang b,et al. d-tagatose-3-epimeraseの特徴 Rhodobacterからsphaeroides that d-フルクトースをd-プシコースに変換する[j]。2009年バイオテクノロジー手紙、31(6):857-862。
[34] mu w, zhang w, fang d,et al., clostridium sp.由来のd-psicose産生酵素、d-psicose 3-エピメラーゼの特徴[j]。バイオテクノロジー手紙、2013年、35(9):1481-1486。
[35] zhang w, fang d, xing q,et al. from novel metal-dependent d-psicose 3-epimeraseの特徴 クロストリジウムscindens 35704 [J]。2013年『Plos One、e62987 8だな
[36] yoshida h, yoshihara a, suzuki t,et al. d allulose産生が可能なshinella zoogloeods由来の新規ケトース3-エピメラーゼのx線構造[j]。9:257-265 2019年それウリBiol fbi。
〔37〕 ムー W CHU F、杏 Q et al. 、クローン表情で、 特性化 of a D-psicose 3-epimerase from クロストリジウムcellulolyticum H10と[J]。農業・食品化学誌,2011,59(14):7785-7792。
[38] zhu y, men y, bai w,et al. ruminococcusからのd-psicose 3-epimeraseの過剰発現 略称はescherichia coli d-psicose製造への応用の可能性[j]。バイオテクノロジー手紙、2012年、34(10日):" 1901-1906。
[39] 張 L,姜 Bムー W et al. Bioproduction D-psicoseの using permeabilized cells 新たに孤立 Rhodobacter sphaeroides SK011 [J]。中国の化学技術のフロンティア,2009,3(4):393-398。
[40] park c, kim t, hong s,et al. d -allulose 3-epimeraseflavonifractor plautiiを発現するコリネ細菌glutamicum細胞の透過性組換え細胞によるd-フルクトース産生[j]。2016年『Plos One 11(7)、e0160044。
[41] yang j, tian c, zhang t,et al. corynebacterium glutamicumにおけるタンデムアイソザイム遺伝子を用いたd-アルロース3-エピメラーゼの食品グレード発現システムの開発とサトウキビ糖分からd-アルロースへの変換への応用[j]。
バイオテクノロジーおよび生命工学、116(4):745-756。2019年
[42] li s, chen z, zhang w,et al.カバイロニアfortuitaからのd-タガトース3-エピメラーゼの特性と希少糖生産への応用[j]。international journal of biological macromolecules,2019,138:5 56 -545。
[43] zhu z, lic, liu x,et al sinorhizobium sp.[j]からのd-タガトース3-エピメラーゼ。2019年RSC進歩9(6):2919-2927。
[44] zhu z, gao d, li c,et al.黄色ブドウ球菌由来の新規d-アルロース3-エピメラーゼの再設計 熱安定性およびd-アルロースの効率的な生物生産のために[j]。微生物携帯工場、2019年18(1):1。
[45] tseng w, chen c, hsu c,et al. agrobacterium sp. atcc由来の組換えd -allulose 3-エピメラーゼの特徴
31749と重要な界面残基の同定[j]。^「international journal of biological macromolecules,2018, 112:767-774」。2018年12月7日閲覧。
[46] yoshihara a, kozakai t, shintani t,et al. gras微生物arthrobacter globiformis m30に由来するd-アルロース- 3-エピメラーゼの精製とその特徴[j]。journal of bioscience and bioengineering,2017,123(2):170-176。
[47] he w, jiang b, mu w,et al. d-psicose 3-エピメラーゼを用いたd- alluloseの産生[j]。農業・食品化学誌,2016,64(38):7201-7207。
[48] zhang w, zhang t, jiang b,et al. d-psicose 3の生化学的特徴- treponema primitiazas-1由来のエピメラーゼ 酵素によるd-プシコース産生への応用[j]。食料農業の科学誌に、2016 96(1):49-56。
[49] zhang w, li h, zhang t,et al.からのd-プシコース3-エピメラーゼの特性 dorea sp. cag317 phが最適で比活性が高い[j]。2015分子煤油炉B-Enzymatic会雑誌と120:68-74下位です。
[50] zhang w, zhang y, huang j,et al. dorea sp. cag317のd-アルローズ3-エピメラーゼの界面領域での部位特異的変異誘発による熱安定性向上[j]。農業・食品化学誌,2018,66:5593-5601。
[51] patel s n, kaushal g, singh s .熱水生生物のメタゲノムからの新規d-アルロース3-エピメラーゼ遺伝子の特徴付けおよび枯草菌全体細胞触媒によるd-アルロース産生[j]。applied and environmental mic - robiology,2019,1:1-8。
[52] 陳 Z、陳 J、張 W et al. 改善 thermostability and catalytic 行動 of L-rhamnose isomerase caldicellulosiruptor obsidiansis ob47から部位特異的変異誘発によるd alluloseへ[j]。農業と食料に関する雑誌 化学、2018年66(45):12017-12024。
[53] park c, park c, shin k,et al. agrobacterium tumefaciens由来のd-psicose 3-epimeraseの高発現を有する全組換え細胞によるd-fructoseからのd-psicoseの生産[j]。^「bioscience and bioengineering」。journal of bioscience and bioengineering(2016年). 2016年12月12日閲覧 190.
[54] 陳 J、朱 Y、扶安 G et al. ハイレベル 中内 and extra-cellular production of D-psicose 3-epimerase を介して a bacillus subtilisにおける修飾されたxylose-inducible expression system [j]。journal of industrial microbiology &2016年バイオテクノロジー43(11):1577-1591。
[55] liz, li y, duan s,et al. saccharomyces cerevisiaespores上の固定化されたd -キシローイソメラーゼおよびd -プシコース3-エピメラーゼによるd -グルコースからd -プシコースへの生物学的変換[j]。journal of industrial microbiology &バイオテクノロジー42(8日):2015年、1117 - 1128。
[56] yang p, zhu x, zheng z,et al. セル 再生 and 循環 catalysis 人工の Kluyveromyces marxianus の agrobacterium tumefaciensのd-アルロース生産のためのd -psicose-3-epimerase遺伝子[j]。^ world journal of microbiologyによる & バイオテクノロジー34 2018年、(5):7勝13敗。
[57] li c, zhang c, lin j,et al. d-psicose生物生産モデル溶液からの酵素的フルクトース除去とシステムモデリングとシミュレーション[j]。journal of chemical technology &バイオテクノロジー93 2018年、(5):1249-1260。
song y, nguyen qa, wi sg,et al. cruciferous vegetable residueからの付加価値製品としてのバイオエタノールとd-psicoseの二重生産戦略[j]。Bioresource技術223:34-39、2017年であり、
[59] he x, zhou x, yang z,et al.大腸菌jm109からのd-tagatose 3-エピメラーゼ遺伝子のクローニング、発現および精製[j]。タンパク質の&です;2015、潔斎と114:77-81下位です。
[60] li c, lin j, guo q,et al. d-psicose 3-エピメラーゼ分泌過剰発現、固定化、およびd-psicose生体変換、分離および結晶化[j]。journal of chemical technology &バイオテクノロジー93 2018年、(2):ギター350-357。


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本




