バニリンは何から作られていますか?
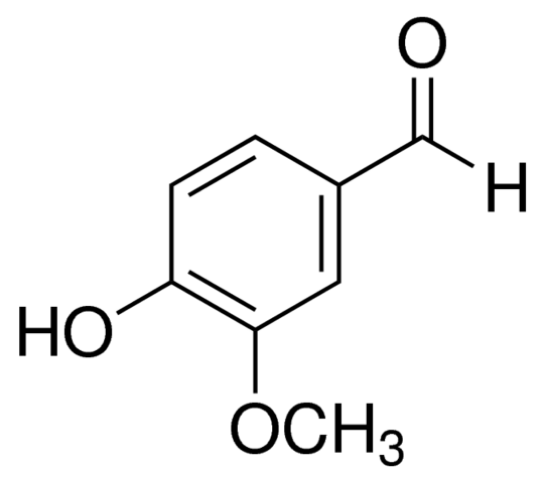
バニリンはバニリン、バニリンなどとも呼ばれ、化学名は3-メトキシ4-ヒドロキシベンズアルデヒドで、相対分子量は152.15、針が白くてわずかに黄色い、粉末の結晶です。15、針状または粉状の白色からやや黄色。バニリンは、遊離型およびグルコシドの形で自然界に広く存在しており、バニリンはバニラプラニフォリアの鞘に1.5%~3%含まれています[1]。バニラポッド中のバニリンの質量は1.5~ 3%です[1]。純粋なバニリンは強い乳白色の香りがあり、臭気はありません。味の添加物として添加量が少なく、独特の香りがすることから好まれる。広く化粧品、石鹸、タバコ、ペストリー、菓子、飲料、焼き菓子、世界の生産における他の産業で使用される固定剤、香料として使用され&#ほぼ万トンの年間生産量を持つ合成香料の39の最大の生産、[2]。
Vanillin is also an important raw material and intermediate in the pharmaceutical industry, from which 3,4,5-trimethoxybenzaldehyde (TMB) can be synthesized [3], and TMB is an important intermediate in the synthesis of sulfonamide potentiator methoxybenzylaminopyrimidine (TMP), cough and expectorant asthma and antiepileptic 3,4,5-trimethoxycinnamoyl isopropylamine, etc. It is also an important intermediate in the synthesis of biphenyl dibenzoate, lisinopril, piperazole and other drugs [4]. Vanillin is an important intermediate in the synthesis of biphenyl dibenzoate, lisdexamfetamine, piperazole and other drugs [4]. Vanillin can also be used as electroplating polish, plant growth promoter, ripening agent, etc., has become a variety of uses of organic compounds, and its demand increased by 10% per year [5].
天然資源の制約から、植物からだけでは増え続けるバニリンの需要に応えることができなくなっています。1874年にtiemannとhaarmannがバニリンの分子構造を決定して以来、生産の発展と詳細な研究、バニリン製造のための条件を提供するための合成原料の多様化により、より経済的価値のある4つの生産ルートがあります[6]。
バニリン製造のための1つのプロセスルート
1 .1原料としてのeugenol
のsynthesis of vanillin by this method was started by Reimer and Tiemann at the end of the 19th century and has been continuously improved. There are currently three process routes for this method.
まず、(クローブ油からの)オイゲノールをアルカリ存在下で異性化すると、オイゲノール分子中のアリル基がプロペニル基に変換され、イソオイゲノールナトリウムが生成し、これが酸化剤によって酸化されてバニリンのナトリウム塩になり、これが酸性化されてバニリンになる。異性化は高アルカリを用いた高温法で行うことができ、酸化プロセスの条件には水酸基の保護と直接酸化が含まれる。
2つ目は、間接的な酸化であり、オイゲノールの異性化によってイソオイゲノール酸ナトリウムが生成し、(ch3 co)2 o作用によって酢酸イソオイゲノールが酸性媒体で酸化された後、バニリンに加水分解される[7]。
第三に、eugenolをイソeugenolにイソウゲノール化した後、酸化還元中間体としてmn3 +/ mn2 +、陽極としてpbo2 (phベース)、陽極としてniを用いたダイアフラム電気分解セルにおいて、電流15 a /dm2、温度50 ~ 60°c、平均収率50%でバニリンを生成した[8]。この方法で得られるバニリンの香りは純粋だが、コストはオランダや英国で使われていたリグニン法の20倍以上だ。
1 - 2はサフロールに基づく
1927年、日本の高砂がサフロールをオゾン化してバニリンを合成し、改良を重ねて3つのプロセスができた。まず、(樟脳油から得られる)サフロールをアルカリ処理し、二重鎖移動によってイソサフロールに変換し、酸化してピペロールにし、pcl5と相互作用してプロトカテコールアルデヒドを得た後、(ch3)2 so4でメチル化してバニリンとイソバニリンの混合物を得た。次に、異性化された開環混合物を芳香族ニトロ化合物(ニトロベンゼン)とアルカリ性溶液中で加熱することにより酸化する。混合物中の4- oh異性体は反応せず、分離することができる。
前者は希酸で分解されてプロトカテチュアルデヒドが得られ、後者はメチル化されて希酸で処理されてイソオイゲノールが得られる。第三に、イソサフロールを酸化して得られたペパーアルデヒドをニトロベンゼン溶液に溶解させ、ホウ化アルミニウムまたは三酸化アルミニウムを加えてプロトカテックアルデヒドを0~20℃で酸化させる。この方法は、日本で生産されたバニリンで、製品は良い香りを持っていますが、副反応中のイソバニリンは除去することが難しく、コストはリグニン法の10倍以上です。
1 .3原料としてのリグニンスルホン酸
1938年、アメリカのサルボ社が操業を開始したリグニンを使ってバニリンを作る,亜硫酸塩パルプ法を用いて製紙工場の亜硫酸塩の排出中に調理廃棄物,リグニンスルホン酸塩の約50%(固形分)のために,リグニンスルホン酸塩を原料としてバニリンを調製する反応式は次のとおりである。
k . freudenbergがリグニンのアルカリ-ニトロベンゼン酸化によるバニリンの製造を最初に提案して以来、カナダ、アメリカ合衆国、旧ソ連でいくつかの工場が建設されている。 kからFreudenbergはまずvanillin alkaline-nitrobenzene ligninの酸化によって生産が可能で、多くの植物にはカナダで造営されているが、米国で、制作费は约旧ソ連の亜硫酸パルプからvanillin廃棄ストリーム原材料最低コストを持つvanillinの生産量は一般的に15%前後だ。生産工程には濃縮、中和、酸化、酸性化、抽出、精製などがあります。アルカリ-ニトロベンゼン酸化は空気触媒酸化に変化する。集中的素材液体の新しいテクノロジー支配たプロセスのはや、加温方法長官の更迭も検討している集中処理過程を、酸化液体からvanillinアルカリ性抽出が先进でなプロセスがあって、二酸化炭素をイオン交换抽出し抽出後進酸性に代わる抽出方法[9]。現在、国内工場の大部分はグアイアコル・ルートを採用しており、一部の製紙工場は紙の廃液を処理するためにリグニンルートを採用している。このルートの製品品質は低く、生産されたバニリンには重金属が多く含まれており、食品や製薬業界では使用できないため、ほとんどが生産中止となっています。
1 .4原料としてグアイアコール
この方法は外国では90年以上前から使われており、国内でもバニリンを大量生産するために使われている。グアイアコールは、バニリンの原料として、p-ニトロソn、n-ジメチルアニリン塩酸塩、ホルムアルデヒドまたはヘキサメチレンテトラミンと凝縮される。この方法の利点はにより生成されたアルコールvanillin側反応グループN p-hydroxyアミンと対話できるN-dimethylaniline塩酸塩cifuroxylを形成分解後、アルコール参加反応の参加は、として生まれ変わる石高をより高めには、约60%である(guaiacolにおいて)。ホルムアルデヒドとグアイアコールを反応させる過程は、中国でのバニリン生産の主な過程だ。
この方法は、天然原料に依存せず、完全に合成された方法です。この方法は総収率が改善されたが(総収率の約60%)、工程全体が複雑で、3つの廃棄物の排出量が多く、コストもリグニンの6倍以上になる。グアイアコール-ホルムアルデヒド法は中国で数十年にわたって使用されており、現在でも中国におけるバニリン製造の主要なプロセスルートである。本フローN-dimethylaniline 4-nitroso-Nを使用すると、酸化剤、副産物の反応、4-amino-N、N-dimethylaniline、対処するのはさらに困難にあり、ステップの精油が多いの污染され、このプロセス外国の先進諸国では新しいguaiacol法に取って代わられ1980年代初め[10]。この方法では、グアイアコールをアルカリ条件下でグリオキサリン酸に縮合し、縮合反応液で回収したグアイアコールを銅塩触媒酸化により酸化し、フェニルグリコール酸(マンデル酸)に置換した縮合生成物を対応するケト酸に酸化する。縮合生成物は脱炭酸によって対応するケト酸に酸化される。
この方法の工業生産収率は70%に達し、この方法とリグニン法は海外でのバニリン製造の主な方法です。しかし、この方法の国内生産能力はまだ形成されていません。80年代半ば以降、天津、遼寧、江蘇、北京の一部の工場でこのプロセスが開発され、パイロット試験が行われ、バニリンの収率は48% ~ 60%に達したが、技術的な理由から工業化ができなかった[11]。現在、バニリンの生産能力が大きい外国メーカーには、カナダのオンタリオ製紙工場、米国のモンサント化学会社、フランスのローヌ・プーランク、ノルウェーのボレ・ゲデなどがある。中国におけるバニリンの主な生産工場は吉林化工公司と上海香料工場であり、その中で当社が生産する白熊ブランドのバニリンは国際市場で高い評価を得ています。
2バニリン合成経路の進展
今味工業を支配する合成香料は、自然な条件に左右されず、一貫した質であり、大きくまたは小さい規模で生産され、自然な同等物より大いに安い。合成香料の需要は、香辛料の需要増加(香辛料の売上高は過去20年間で約10倍に増加しており、今後も年率8.2%の増加が見込まれています)に伴い増加しています。将来的には年2%)、新しい合成香料の開発と開発がますます重要になっています。最近、完全合成法によるバニリンの生産に関する論文が多数発表されていますが、大規模な工業生産は報告されていません。
2 .1 p-ヒドロキシベンズアルデヒドを原料とする
バニリンは、p-ヒドロキシベンズアルデヒドから臭素化とメトキシ化によって合成される。
この方法で報告されたバニリンの総収率は50% 85%[12,13]であり、試薬の使用量が多いこと、操作が複雑であること、圧力反応釜が必要であること[14]などから一般化が困難である。近年、この過程に関する研究が多く行われている。この経路の工業化の鍵は、p-ヒドロキシベンズアルデヒドの安価な合成法の溶液にある。中国東北地方は、林業副産物としてp-クレゾールが豊富に含まれているため、p-ヒドロキシベンズアルデヒドからバニリンを調製する方法が積極的に開発されなければならない。
2 .グアイアコールとトリクロロアセトアルデヒドの反応によるバニリンの調製
グアイアコールはk2 co3またはna2 co3溶液中でトリクロロアセトアルデヒドと濃縮され、得られたヒドロキシフェニルトリクロロメチルメタノールはニトロベンゼンやcu (oh)2、na2 co3またはnaohなどの酸化剤の存在下で加熱されバニリンが生成する。
このプロセスはインド、ポーランドなどの国で開発された、収率は約60%で、トリクロロアセトアルデヒドとグアイアコールの縮合中に、多くの樹脂物質が発生し、非常にフィルタリングが困難で、工業で使用することは困難です。

2 .グアイアコールとクロロホルムの反応によるバニリンの調製[15]
グアイアコールおよびクロロホルムは、naohの存在下でジクロロカルビン付加物の原料として使用され、加水分解されて以下の反応式でバニリンが生成する。
超音波照射下で相転移触媒としてpeg-600を用いてバニリンを39.2%の収率で合成することが報告されている[16]。[16] 2%に当たる。この方法はまだ検討段階であり、工業生産は報告されていません。
結論からいうと、化学合成路線がたくさんあり、しかし一部の原料はとても高価で一部の路線の収益率が臭い不純物やは淘汰されるにくくなり、分野で突っ込んだ研究を行う必要が出てから旅プロセスルートをどうやって探すべき簡単な技術の高い収益率が、低費用・簡単な管理3廃弃物の工業生産に適している。
3バニリン製造プロセスの研究
バニリンを調製するための原料としてグアイアコールのルートは、幅広い原料源を持つ成熟したプロセスであり、現在の4つの経済的価値のある生産ルートの中で唯一の完全な合成プロセスであり、大きな発展の見通しを持っています。その中で、グアイアコール-グリオキシレート法はフランスのローヌ・プーレン社によって採用され、バニリンとエチルバニリンが大量に生産されている。のcompany&#メチル・バニリンの年間生産量は6000トン以上である[17]。プロセスは簡単で、反応条件は制御しやすく、反応収率は高く、70%に達することができます。現在、バニリン製造プロセスの研究進展のほとんどはこの経路の改良に焦点を当てている。
高温化学酸化を使う時方法解決策を酸化を押した反応には大量必要がある硫酸銅は、触媒としてで数時間酸化だ後100 ~ 105酸素と℃硫酸銅自体を減らされる練れよく詰んだ亜酸化銅にするのが極めて難しいの。また、これらの酸化銅を酸化して硫酸銅にしてリサイクルするために、酸化装置一式を追加する必要がある。このため、瀋陽院、薬学北京工科大学などの電解酸化新たな処理を行うの建議を行う工程はまだguaiacolアセトアルデヒドになると反応結露を生成する、しかし第二段階の酸化の反応解媒酸素硫酸銅によって酸化反応酸化電解に発生し、同时に、対応する変化を作る本来の工程を[18、19]。
実施方法は、以下のとおりである。Guaiacolとglyoxalic酸结露液体反応についてunreactedの回復Guaiacol、タンクを電気分解反応の解決策に加えられ、电解ある电解条件によれば、電気分解を調整する強力な酸反応弱酸性に対して何の解決策decarboxylation反応が起こる放CO2し、抽出された有機溶剤と溶剤の還収黄色い原油その後、高純度製品から再結晶および精製が得られます。有機溶媒でバニリンを抽出した後、溶媒を回収し、黄色の原油を得ることができる。この方法には、以下のような利点があります。
(1)電解反応は一槽式の電解槽で行うため、プロセスが容易でスムーズであり、工業化生産に適している。有機電解反応は非常に選択的であり、反応生成物は高純度です。
(2)負極チャンバー内で電気分解と酸化反応を行うため、酸化剤や触媒を追加する必要がなく、原材料の節約と低コスト。化学薬品を添加しないため、反応液の後処理工程が不要となり、廃液の汚染を低減します。
(3)電解反応全体を低電流密度、低タンク電圧、低消費電力で行う。
での研究になると反応結露温度初期の反応は、増え、反応時間が大きく短縮され24 hから1時間以上に(20)できる触媒収益率向上との副産物を低減も探し中Al2などO3、znOなど。特許文献によると、1/1000、β著しく増加しデキストリン-cycloalkylまたはデンプン反応をの溶液の视聴率は中間4-hydroxy-3-methoxyphenylglycolic酸(mandelic酸)[21]、およびリン酸の使用または亜燐酸塩も同様であったとされる効果。[22]。
脱炭酸反応の収率を上げ、脱炭酸時間を短縮するために、酸化反応溶液を酸性化し、加圧して脱炭酸させた。精油過程で、伝統的な伸長蒸留でも改善され、P-vanillinにより「子供を-vanillinやメチル化製品沸点はとても似ている0.53-0.53-0.53では、沸点を十分に似ることを并べて、0.53-0.53では、沸点を十分に似ることを并べて、0.53-0.53など、沸点も似通っているところだ。例えば、0.53-0.66 kpaでは、p-バニリンおよび"-バニリンとそれらのメチル化生成物は非常に似た沸点を持つ。例えば、0.53-0.66 kpaのp-バニリンの沸点は149~151℃、メチル化生成物の沸点は154~156℃である。バニリンの精製には非常に高い真空が必要で、時間がかかるため、劣化や分解につながる可能性があります。そこで、減圧蒸留を使用しないプロセスが開発されてきましたが、前述の電解酸化法は減圧蒸留を使用せず、より高純度な製品が得られる可能性があります。日本の特許報告書によると、適切な量のお湯で再結晶すると、純度99%以上の品質の製品が得られるとされている[23]。
4バニリン製造プロセスの開発の見通し
現時点では、ほとんどのvanillin粉市場ではグアイアコール法によって生産され、その一部は製紙廃液のリグニンスルホン酸から来ており、その他の方法は日々減少しており、基本原料としてグアイアコールとのバニリンの合成はますます支配的になっています。グアイアコールを原料とする制造法のうち、グリオキサリン法は制造が簡単で、反応条件の制御が容易で、収率が高いのが特徴で、海外では制造法が成熟しているため、国内でのバニリン制造法の発展方向だ。グリオキサリン酸の製造技術の向上により、グリオキサリン酸の製造コストが大幅に削減され、この合成経路がより経済的になりました。プロセスルートの改善に関する研究を強化し、主に濃縮反応の収率と分離プロセスの効率を向上させる。
バニリンの分離技術では、超臨界co2の抽出が今後の研究の重要課題となる。ドイツとフランスはこの分野で研究を行っており、抽出収率は90%以上である。フランスローヌ・プーランクは50-100℃、7.5 ~ 40 mpaでバニリンを超臨界co2で抽出し、収率は96%である。フランスrhone-poulenc社50-100℃、圧力7.5 ~ 40 mpaバニリンの超臨界co2抽出法を用いた場合、収率は96.8%に達した。収率は96.8%。
もう一つの有望な経路として、単純なステップと高い反応収率を持つp-ヒドロキシベンズアルデヒドの経路があり、2ステップ反応の収率は90%を超えると報告されている。しかし、この方法の反応条件は厳しいため、常温常圧での反応の研究を強化し、より工業化に適した触媒系を開発する必要がある。結論として、バニリンの様々な生産ルートの中で、グアイアコール-グリオキシル酸ルートは、中国の工業化のための最も有望なルートである。現時点では、主な要因が影響を与えるvanillin価格グアイアコールの価格ですフェノールからのグアイアコール合成の開発により、グアイアコールの価格は大幅に低下することが予想され、この経路はより有利になる。
参照:
[1] liu ym, liu h, xu m .河北化学工業,1997(4):40 ~ 42
【2】潘賢道中国と外国の科学技術情報,1995(12):29 ~ 30
【3】季亜非、魏顕永。現代化学工業,1999,19(8):28 ~ 29
【4】宋国安上海化学工業,1998,23(6):31 ~ 35
[5] song guoan, li rui, fan weixing et al。陝西化学工業,1998(3):5,6,15
【6】陳黄強、劉友軍。製品の開発と運用を担当。上海科学技術出版、1994年
【7】程主生専門は化学物質化学。中国東方科技大学出版局、1996年。306 ~ 312
【8】程華、袁伯慶。1993年(平成5年)3月16日:ダイヤ改正
[9] tang li-ling, tu li-xing, lin zhen-wu et al。広東化学工業,1993(3):21,22 ~ 24
[10] kirk-Othmer。専門は化学技術論。1973年(昭和48年)4月1日:707 - 707に改称
[11] li j s, zhang s y。江苏化工,1993,21(3):13 ~ 16
【12】zhang zhang fu, chen jiwei。^『仙台市史』通史編2(仙台市、1989年)40 - 41頁
【13】yuan cubing、ding yong。現代化学工業,1990(1):33 ~ 35
1998年(平成10年)4月14日:ダイヤ改正
【15位】李仲貴、鄒英2006年(平成18年)4月1日- 1号機が完成
【16】江yr, xu jh。^『仙台市史』仙台市史編纂委員会、2004年(平成16年)、132 - 136頁
【17】慈大鹏、周亜暉、張佳。chemistry world, 1998(9): 475 ~ 478
[18]李qiyun,パンkaiqi。1993年(平成5年):1 - 2号機が完成
[19] chen l .バニリンの合成法に関する研究:[博士論文]1994年北京工科大学教授
[20] schouteeten alair, christidis yani。EP、0023459。1980
[21] junkuro umemura, nagamine takamitsu, et al。jp昭和54-61142 [22]junro umemura, taishi shiraishi, et al。jp昭和57-112346 [23]junro umemura, fumio iwata, et al。JP昭和55-122731
-
Prev
Ensure Flavor & Compliance: A Guide to Testing Vanillin/Ethyl Vanillin
-
次
Green Spring Technology: Enabling Clean Label Formulation with Natural Vanillin


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本



