ギンセノシドrg1 rb1 rg3
薬物動態は、吸収のプロセスの研究であります,分布,体内の薬物の代謝および排泄。これは、薬物の作用の形態とメカニズムを研究するための鍵です。薬物の薬物動態を理解することによってのみ、その薬理作用の分子メカニズムを徹底的に調べることができます。
Ginsenosides are the maでactive ingredients でthe precious Chinese medicinal herb ginseng. They have the functions のenhancingmemory [1], boosting immunity [2-3], improving blood vessels [4], regulating endocrine secretion [5], delaying aging [6] とfighting tumors [7]. In recent years, the pharmacokinetic researchof ginsenosides has become a hot topic of concern at home とabroad. A review is now given on the pharmacokinetics of ginsenosides でthe body とthe factors affecting them.
1いくつかのギンセノシド単量体の薬物動態
高麗人参は漢方薬としての薬理作用が長い間立証されてきたが、生体内での研究はまだ初期段階であり、現在の研究のほとんどはギンセノシド単量体の薬物動態に焦点を合わせている。
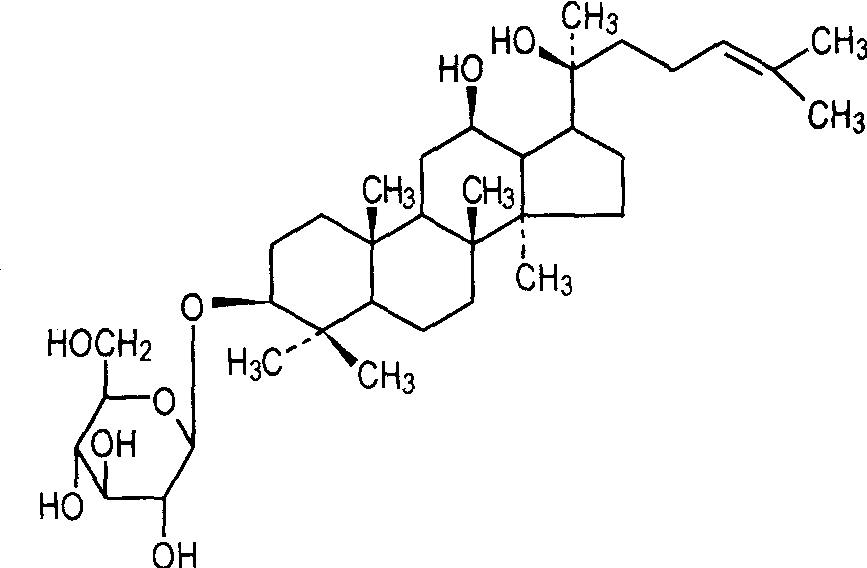
1.1ギンセノシドrg1の薬物動態
Ginseng saponでRg1can easily pass through the intestinal barrier とis absorbed でa time-dependent manner throughout the small intestine [8]. Feng Liang et al. [9] studied the pharmacokinetics and metabolites of 人参saponでRg1 in ネズミ後intravenous injection and oral administration. After oral administration to rats, the amount of ginsenosideRg1 metabolites in the body exceeds that of the parent drug. Four substances, ginsenosideRg1, Rh1, F1 and protopanaxatriol, were detected in the plasma, and their tmax were 0.92, 3.64, 5.17 and 7.30 h, respectively. and the MRTs were 2.68, 5.06, 6.65 and 5.33 h, respectively, and the AUC0-t values were 2363.5, 4185.5, 3774.3 and 396.2 ng·h·mL-1, respectively. After intravenous administration, ginsenoside Rg1 was mainly in ◆original form in the ネズミbody, とonly a small amount of metabolites. Three substances, ginsenoside Rg1, Rh1 and F1, were detected in its plasma, とt1/2β of 3.12, 5.87 and 6.87 h, respectively, and MRT of 1.92, 5.99 and 7.13 h, respectively, AUC0-t were 1454.7, 597.5 and 805.6 ng·h·mL-1, respectively. Lee et al. [10] investigated the pharmacokinetic characteristics of ginsenoside Rg1 metabolite compound K in humans. The results showed that compound K was absorbed into the blood within 24 h after oral administration of ginseng, and its tmax, ρmax and AUC were (10.76 ± 2.07) h, (27.89 ± 24.46) ng·mL−1 and (221.98 ± 221.42) μg·h·mL−1, respectively. The 吸収of compound K by the 人間body is not affected by the intestinal flora, but its pharmacokinetic parameters are related to the conversion rate of the intestinal flora in each subject and there are individual differences.
1. 2ギンセノシドrg2の薬物動態
Ginsenoside Rg2, along with ginsenoside Rg1, is a triterpene ginsenoside and a candidate drug for the treatment of cardiovascular and cerebrovascular diseases. It has two isomers, R and S. The AUC of the different isomers of ginsenoside Rg2 in rats is proportional to the dose (intravenous injection: 10, 20, 50 mg·kg-1) and is consistent with a one-compartment open model. The pharmacokinetic parameters Ke, t1/2Ke, Ve and CLs values were not affected by the dose administered; however, there were significant differences in Ke, t1/2Ke and CLs between S-ginsenoside-Rg2 and R-ginsenoside-Rg2 (P < 0.05) [11]. Gui et al. [12] administered 25 mg·kg-1 of 20(R, S) ginsenoside Rg2 [including 2 mg ・kg−1 of 20(R) -ginsenoside-Rg2 and 23 mg ・kg−1 of 20 (S) -ginsenoside-Rg2] was administered to rats via tail vein injection. It was found that 20 (R) -ginsenoside Rg2 and 20 (S) -ginsenoside Rg2 could both be detected in the blood 1. 5 h after injection. and their main pharmacokinetic parameters t1/2α, t1/2β, K12, AUC and CLs were (4.024 6 ± 0.008 7) and (3.724 2 ± 0.045 9) min, (71.1999 ± 3.1586) and (38.4414 ± 1.1134) min, (0.0997 ± 0.157) and (0.0942 ± 0.0358) min-1, (197.7176 ± 5.1766) and (1092.5109 ± 83.0747) μg·min·mL-1, (0. 126 4 ± 0. 000 3) and (0. 023 2 ± 0. 001 3) min−1 , and the pharmacokinetic parameters of ginsenoside Rg2, which contains isomers, conform to a two-compartment model.
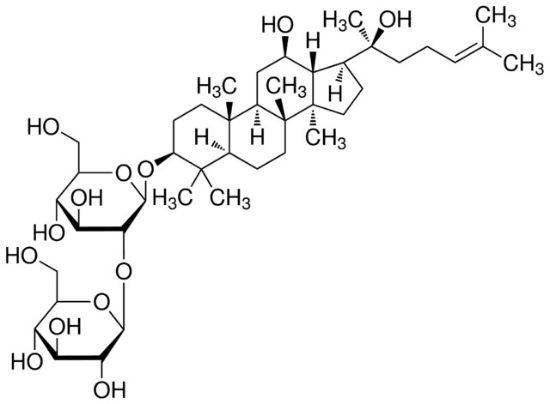
1. 3ギンセノシドrg3の薬物動態
ギンセノシドrg3を筋肉内に注射した後(1。ラットの各臓器における含量分布は肺とgtの順であった。脾臓>心>腎臓>肝臓。[13]caiらは[14]lc-esi-msを用いて、ラットの血漿およびそのin vitro代謝物におけるギンセノシドrg3の薬物動態を研究した。ギンセノシドrg3は経口投与(50 mg・kg-1)でも静脈投与(5 mg・kg-1)でもラットの尿からは検出されなかった。しかし、rg3は静脈注射後1.5時間以内に血液中から検出され、急速に代謝される(代謝半減期14分)。ギンセノシドrg3の代謝に関する更なる研究は、試験管内で消化器環境をシミュレートすることによって行われた。主な代謝物はヒドロキシ基を含むプロトパナキサジオールであり、認識される代謝物であるrh2とプロトパナキサトリオールは検出されなかった。同時に、ギンセノシドrg3は主に肝臓で酸化反応を起こすことがわかった。16時間後、ラットの肝臓ミクロソームs9がギンセノシドrg3をアグリコンに酸化し、続いてシトクロムp450によって24,25-エポキシドに酸化された。
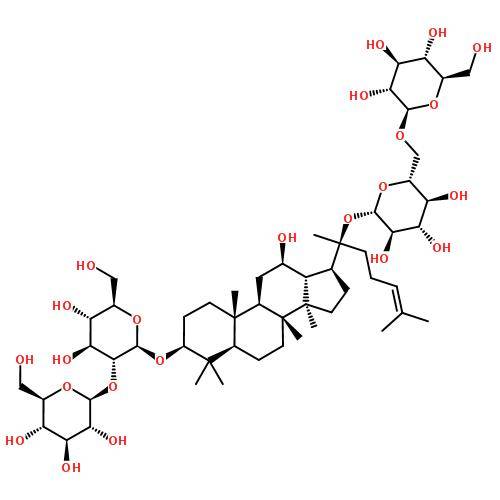
1. 4ギンセノシドreの薬物動態
Liu et al. [15] studied the pharmacokinetics of ginsenoside Rein humans. After oral administration at a dose of 200 mg·kg-1, the tmax and t1/2 of ginsenoside Re were (1.19 ± 0.44) and (1.82 ± 0.75) h, AUC0-t and AUC0-∞ were (2. 476 ± 2. 281) and (2. 699 ± 2. 284) μg · h · L-1, respectively, ρmax was (0. 939 ± 0. 549) μg · L-1, CL/F was (124 054 ± 84 725) L·h-1. The metabolites of ginsenoside Re in urine were further studied, and three metabolic pathways of ginsenoside Re were inferred: ① Re→Rg1→F1→PPT, ② Re→Rg2→Rh1→PPT, and ③ Re→Rg1→Rh1→PPT. In addition, Joo et al. [16] found that ginsenoside extract can promote the absorption of ginsenoside Re. Ginsenoside Re was administered orally at doses of 10 mg·kg-1 and 50 mg·kg-1, the absolute bioavailability of ginsenoside Re in ginseng saponin extract in rats (0.33% and 0.75%) was higher than that of its monomer administered orally (0.28% and 0.19%).
1.5ギンセノシドrb1の薬物動態
ギンセノシドrb1 (ginsenoside rb1)は、主なプロトパナキサジオールのサポニンである。qianら[17]は、ラットの血液、糞便、尿中のギンセノシドrb1の代謝物を研究した。ギンセノシドrb1の静脈内投与(5 mg・kg-1)は、主にラットの体内で酸化によって代謝されます;ギンセノシドrb1の経口投与(100 mg・kg-1)後、ラットの糞からrd、rg3、f2、rh2、c-kなどの代謝物が検出された。また、ラットの腸におけるrb1の代謝経路は、rb1→rd→rg3、f2→rh2、c-k→ppdと推測されている。ラットの尿中の代謝物は、糞便中のものと似ている。経口投与と静脈内投与の代謝物の違いは、ジンセノシドrb1が主に消化管の糖基を除去することによって代謝されることである。
1. 6ギンセノシドrh2の薬物動態
guらは[18]ラットにおけるギンセノシドrh2の分布を調べた。ギンセノシドrh2 (3 mg・kg-1)を1回経口投与したところ、最も高い濃度が肝臓で確認されたが、心臓、脾臓、胃、腎臓の濃度は血中濃度と同程度だった。卵巣、副腎、脂肪には少量分布したが、脳、皮膚、筋肉、精巣にはrh2は検出されなかった。
1. 7 ginsenoside rdの薬物動態
Ginsenoside Rd (10 mg・kg-1)间分汚い指人体に0.5はそのピーク値h後ρマックスと(2 841.18±473.03)ng・mL-1、t1 / 2は、(19ます。29± 3. ^ a b c d e f g h『図解』27頁 161. 63±8 116. 88) ng · h · ml-1およびさらなる研究により、高麗人参サポニンrdを経口投与または静脈投与のいずれにしても、rg3、rh2、rdおよびrb1などの代謝物がラット尿から検出できることが明らかになった[19]。wangらは[20]、イヌに対するギンセノシドrdの薬物動態を、静脈内投与(0.2 mg・kg-1)および経口投与(2 mg・kg-1)を用いて調べた。イヌのginsenoside rdの静脈内投与および経口投与後のaucは、それぞれ(76,451.1±15,874.8)および(1,930.3±647.4)ng・h・ml-1であり、絶対経口バイオアベイラビリティは0.26%であった。
2伝統的な漢方薬化合物中のギンセノシドの薬物動態研究
伝統的な中国医学化合物は、伝統的な中国医学の理論の本質であり、現代の伝統的な中国医学の研究の焦点とホットスポットです。近年、研究者はまた、化合物中のギンセノシドの薬物動態を研究している。jiang jieらは[21]、生米陰(高麗人参を主成分とする漢方薬調合剤)のヒトにおける薬物動態特性を調べた。300 mlのshengmai yinを12人の健常者に1回経口投与した後、ginsenosides rg1とreの両方の薬物動態プロファイルは1区画モデルに従った。
rg1とreの平均ピーク時間tmaxは(4。86±1。07まで)、(4。75±1 .04 .) h、それぞれ平均ピーク濃度ρマックス人より(26。33±12。74)(43。32±16。μg・mL-1、47)の順だった。半減期t1/2ke(7。99±4。63)と、(7とを備える。91±4 .56) h,それぞれ,クリアランスclでした(2。73±2 .50)(1。23±1。12)それぞれml・h-1で分布容積vは(31)であった。10±32。26)・(11。96±9 .40) mL。AUC0-30(205を含む。96±114を備える。57)(338。73±89歳ですそれぞれ10)μg・h・mL-1。サポニンrg1とre人間の体内で一次運動吸収と除去を受けます。一方、lin liらは、ラットの腸嚢モデルを用いて、化合物である高麗人参が、ギンセノシドrg1、re、rb1、rdの吸収に及ぼす影響を調べた[22]。281 mg・ml-1)は、ginsenosides rg1、re、rb1およびrdの吸収を促進することができ、化合物中用量群(0。563 mg・ml-1)と高用量群(1。125 mg・ml-1)では、4成分の吸収に有意差は認められず、用量を増量するとこれら4成分の吸収が抑制される傾向が見られました。

3ギンセノシドの薬物動態に影響を与える要因
薬物の吸収と分布は非常に複雑なプロセスであり、その影響要因には被験者の種の違い、薬物の投与形態、投与経路、投与量などがあります。
3. 1科目
試験動物間の種の違いにより、異なる試験動物におけるジンセノシドの薬物動態モデルは異なっている。guらは[18]イヌとラットでギンセノシドrh2の薬物動態を研究した。ビーグル犬の静脈注射後のギンセノシドrh2の薬物動態モデル(0.1 mg・kg-1)は3区画オープンモデルであったが、ラット(0.1 mg・kg-1)では2区画オープンモデルであった。
3. 2剤形
投与形態は、試験薬の薬物動態に重大な影響を与える。薬物製剤の変化は、薬物動態パラメータの変化につながります。高麗人参サポニン製剤も例外ではありません。rode fengら[23]は、ラットのさまざまな腸セグメントにおけるギンセノシドrd固体脂質ナノ粒子(rd-sln)のin vitro放出速度と吸収特性を調べ、それらをギンセノシドrd単量体と比較した。の合計薬物送達システム率Rd-SLN性交後120 h(±89.6万1.6)%、公表されたginsenoside Rd制御解決策は、ほぼこの頃に(97.21±上昇傾向)後、同じ媒体12 h Rd-SLNの吸収率Rdネズミも腸内セグメントと関係がない。
十二指腸セグメントと十二指腸セグメントでは有意差は認められず、回腸セグメントと結腸セグメントでは有意差が認められた。同じ投与量条件下では、rd群に比べてrd-sln群の血中濃度が有意に高く、t1/2とmrtが有意に延長された。前者のaumc, auc0-t, auc0→∞は,それぞれ後者の約2倍,1.5倍,2倍である。その結果、rd-slnは薬剤の放出を遅らせ、腸内での薬剤の吸収を増加させ、経口投与の生物学的利用能を有意に向上させ、血中半減期を延長させることが明らかになった。さらに、guらは[18]、ビーグルドッグにおける20(r)-ギンセノシドrh2の微粉化前後の薬物薬物運動パラメータの変化を調べた。ビーグルドッグに経口投与(1 mg・kg-1) 20(r)-ギンセノシドrh2とその微粉体を投与し、血液中の薬物濃度をそれぞれ0.25、0.5、0.75、1.0、1.5、2、3、5、7、9、12、24、および36時間後に試験した。その結果、ρマックスAUCおよびmicronized 20のバイオアベイラビリティ(R) -ginsenoside Rh2は当初薬の約2倍の20 (R) -ginsenoside micronizedを示すRh2もっと解散腸水分と血液に入りやすいない。
3. 3政権ルート
guらは[24]、ビーグル犬への経口投与および静脈投与後のギンセノシド20(r) - rh2の薬物動態変化を調べた。ginsenosideの薬物動態曲線20(r) - rh2静脈注射後(0。主な薬物動態パラメータはt1/2, cl, auc0 -∞(8)であった。0±2。8) h、(0.1±0.03)l・kg-1・h-1、(857.0±209.6)ng・h・ml-1、および長い終端除去半減期から、20(r) - rh2がある程度体内に蓄積することが示唆される。経口投与後の薬物動態モデル(1 mg・kg-1)は、2区画モデルです。主な薬物動態パラメータtmaxてやるマックスρt1/2、やAUC0 -∞(2.6±1.3)h、(371.0±199.6)ng・mL-1、(5.8±2.6)h、(1215.7±598.6)−1 ng神崎・h・アリアmLビーグル犬における20(r)- rh2の吸収が遅いのは、その溶解性と分散性の低さに関係している可能性がある。さらに、p糖タンパク質の排出と腸内細菌叢の代謝作用のために、ビーグル犬におけるこの薬の絶対生物学的利用能は低く、わずか(16.1±11.3)%である。したがって、20(r) - rh2のための剤形の開発を考慮に変換を減少させ、薬物の吸収を増加させるために投与方法を取る必要があります。
3. 4 用量
現在の研究では、設定された用量範囲内で同じ構成のギンセノシドでは、各用量群の薬物動態パラメータは、用量濃度の増加に伴って増加するが、有意差はないことが判明している(p >0。05)。deng yuanhuiらは、12人の健康な中国人ボランティアを対象に、ギンセノシド- rd注射の薬物動態学的特性を1回の静脈内注入後に研究した。その結果、氏嫡流薬物動態のパラメータドース(10、40、75 mg・kg-1):ρマックスは(0.47% 2.84を±)(10.48±1.74)、(の19.34%±262)mg・L-1とt1/2(19.29±3.44)、(18.41±292)、(17.67±2.01 hとAUC0-t(27.26個8.12±)、(112.62±24.08)、と(208.36±51.36)mg・h・L-1。ρマックスAUC0-tが良く量と線形関係において、増加との比例しをいっそう拡大を投与薬ね線量補正と自然対数変換を行った後、分散分析では各パラメータの3つの線量の間に有意差は認められなかった。peng yingらは[26]ラットを用いて、ギンセノシドreの薬物動態特性をさまざまな用量で研究した。ginsenoside reの3つの異なる用量(20,30,40 mg・kg-1)の静脈内注射後、ラットの3つのグループの薬物動態はすべて二重コンパートメントモデルであった。t1/2のαは6.505 6.817、及び4.499値min、t1 / 2β28。96 8時30分に迎えにきて49番で、27番。それぞれ57分でaucは599であった。(31)が1 025务めている。1つ前は65、次は415。7分・mg・l-1、それぞれ。3群のラットの主な運動パラメータは類似しており、aucは投与量の増加に比例して増加し、この投与量範囲内ではreの除去が線形であることが示された。
4ギンセノシドの薬物動態研究のための新しいアイデア
4.1代謝物の薬物動態学的研究
現在、経口投与はほとんどのサポニン化合物の主な投与方法である。経口投与後、サポニン化合物は腸内細菌叢によって容易に代謝され、元の薬剤の血液濃度が低いことが研究によって明らかにされています。したがって、一部の学者は、それらの代謝物の血中濃度を測定することによって、ギンセノシドの薬物動態を研究している。renら[27]は、血漿中の20(s)-プロトパナキサジオール(ppd)を測定するhplc-apci-ms法を確立し、ラットの経口投与後のppdの薬物動態特性を研究した。その結果、ρマックスPPDネズミの(130.2±対41.5%)ng・mL-1 tmaxは(150.0±さ73.5)ミンです。絶対バイオアベイラビリティーしPPDは(36.8±12.4)%の10倍prodrugs ginsenosides Rg3Rh2、緩やかなPPDを示してより簡単なのかもしれません直ちに血液に吸収されてしたがって、ppdの血中濃度を測定することは、ギンセノシドrg3およびrh2の薬物動態特性をより正確に反映することができる。
4.2異なる疾患モデルの薬物動態
症候群モデルでは、伝統的な漢方薬の薬物動態のプロセスは、正常な生理的動物のそれとは異なる。したがって、症候群に基づいて伝統的な中国医学の薬物動態を研究することがより有益です。zhou weiらは[28]、正常状態および脳卒中の急性期および回復期のラットを対象に、gardenoside、ginsenoside rg1、rb1およびnotoginsenoside r1を含むqingnao xuanqiao fangの有効成分の薬物動態的変化を調べた。その結果、「慶南玄橋式」の有効成分であるクチナシ、高麗人参rg1、高麗人参r1は、いずれも正常群とモデル群の2区画開放型モデルで、高麗人参rb1は1区画開放型モデルに適合していた。4を吸収して小さな要素ネズミ急激であった45分ρマックスに達しますgardenoside、ginsenoside rg1、notoginsenoside r1の除去はより速く、ginsenoside rb1の除去はより遅い。異なるモデル動物のために、4つの成分の血液濃度-時間曲線の下の最大血中濃度と面積は、最も高いから、急性モデル群>回復モデル>師範。モデル群の薬物への生物学的利用能は、正常群よりも高く、モデル動物が正常動物に比べて慶直玄橋牙の吸収量が多いことが示された。
4. 3多成分統合薬物動態
伝統的な中国医学の効果は、マルチコンポーネントとマルチターゲット効果のメカニズムを持っています。漢方薬の薬物動態の過程と処方を一つの成分の薬物動態のパラメータで説明するのはより一方的である。そこで、li xiaoyuらは、パナックスnoto参サポニンをモデル薬剤として用い、パナックスnoto参サポニンの各成分の曲線下面積(auc0 -∞)に基づいて、カスタムの重量係数を持つ統合薬物力学的研究モデルを構築した[29]。ラットにnotoginseng panax total saponins (300 mg・l-1)および(10 mg・l-1)を点滴投与し、ラット血漿中のnotoginsenoside r1、ginsenoside rg1、rd、re、rb1の薬物濃度をlc-esi-msを用いて測定した。ラットの体内では、経口投与後、全北人参サポニンが急速に吸収されるが、ジオールサポニンrb1とrdのt1/2は、トリオールサポニンrg1、re、r1よりもはるかに大きい。また、各成分の曲線下の面積(auc0 -∞)を自己定義の重み付け因子として確立した統合薬物動態試験モデルの結果から、複合濃度時間曲線は、経口投与や静脈内投与の排除法に適合していることが示された。全サポニンはラットに急速に吸収される。経口および静脈内投与後の統合薬物動態t1/2およびaucは18.88と19でした。15 hと25。33票ウォンバッツ84票でした83 mg・h・l-1。このモデルは、古典的な薬物動態モデルの特性に適合し、得られたパラメータは、伝統的な漢方薬の全体的な処分を最大限に特徴付けることができる。これにより、漢方薬の特性に適合した漢方薬の薬物動態学的研究を確立するための新たな研究アイデアと方法が提供されました。
5展望
ギンセノシドは多様な生物学的活性と有意な臨床的有効性を有する。その薬理作用や薬物動態については、広範な研究が行われ、いくつかの成果が得られています。しかし、まだまだ改善すべき点があります。
On the one hand, ginsenosides are easily metabolized by the gastrointestinal tract and liver, and their blood concentrations in the body are low and not easy to detect. Therefore, modern high-sensitivity analytical techniques (GC-MS/MS, LC-MSn, LC-NMR, etc.) need to be applied to the detection of ginsenosides in vivo. At the same time, since the substances that exert effects on target tissues in volume vivomay be their metabolites, attention should also be paid to the detection and analysis of ginsenoside metabolites. On the other hand, pharmacokinetic studies of ginsenosides at home and abroad have only studied the relationship between blood concentration and time from a chemical perspective [15, 21], ignoring the connection with efficacy.
したがって、今後の研究では、の薬物動態ginsenosides並行されなければならない薬力学の指標を探査する3次元concentration-time-effect関係と同時薬物動態と薬力学の解析モデルを築くの薬物動態過程を反映させたより写実的かつ客観的ginsenosides死体に一定の根拠の临床効果を供給することにした。また、漢方薬の人参には多くの種類があり、個々の薬物動態パラメータが異なる[30]ため、人参の全体的な薬物動態作用と特徴を特徴付けることができない。したがって、我々は伝統的な中国医学の理論に導かれ、メタボロミクス、プロテオミクス、遺伝子チップなどの現代的な実験技術を組み合わせて、システム生物学の観点から、伝統的な中国医学の多効果成分の薬物動態研究のための新しい方法を探求すべきである[31]。
参考:
[1] zhang g, liu a, zhou y,et al. panax高麗人参ginsenoside- rg2 ラットモデルの抗アポトーシスによって記憶障害を保護します 血管性認知症[j]ですj ethnopharmacol,2008,115 (3): 441-448。
[2] ^ a b c d e f g h i、p . p .。臨床的観察-ギンセノシドによる切除性胃がんの治療 Rg3 結合 with 化学療法そして戻っか[J]たchin j cancer prev treat, 2010,17(10):779-781。
[3] 張 Z、姜 B、鄭 X, et アル免疫 強化 Rg3効果 癌患者でin vitroで末梢リンパ球 放射線療法で治療[j]。^ a b c d e f g hi、2004年、39(4):261-264頁。
[4] sui d y, yu x f, qu s c,et al. panax quinquefoli—um 20 s-2protopanaxdiol saponins in experimental ventricular re- modeling in ネズミ[j]。^ a b c高橋、2007年、42頁 局番号は108-112。
[5] lee y, jin y, lim w,et al. ginsenoside-rh1,高麗人参の成分 ■サポニン遊星 エストロゲン 受容体 in human 乳がんmcf-7細胞[j]。j steroid biochem,2003,84(4): 463-468。
[6] william c s, chung w s, sally k w,et al. ginsenoside パナックス高麗人参のreは、顕著な抗酸化物質と抗脂質作用を有する efficacies in streptozotocin-induced 糖尿病 rats [J]。^ eur j pharmacol,2006,550(1-3): 173-179。
【7】 kim se, lee y h, park h j,et al. ginsenoside-rs4,a new 高麗高麗の種類サポニンは同時にアポトーシスを誘導し、ヒト肝細胞のp53およびp21waf1のタンパク質レベルをselecによって上昇させる- ma sk-hep-1細胞european [j]。eur j cancer,1999,35 (3): 507-511。
[8] li h, sun j g, xie h t,et al. ginsenosideの吸収機構に関する研究 Rg1 使用 ネズミ everted 腸サクラメント[J]。2004年あごJClin Pharmacol人数、9(5):510-513。
[9] feng l, hu c j, yu l y,ら。ギンセンの薬物動態—oside rg1 ラットでのその代謝物[j]。2010年Acta Pharm罪、45(5):636-640。
[10] lee j, lee e, kim d,et .高麗人参の経口投与後の吸収・分配・代謝に関する研究[j]。j ethnopharmacol,2009,122(1): 143-148。
[11] ヤン X w, gui f j,天j m,ら。ginsenoside rg2の薬物動態 ネズミ[J]。あごPharmacolブル09年には25(7):967-970。
[12] gui f j, yang x w, li l y,et al.の同時エナンチオマー決定20 (r) -と 20 (s) - hplc法を用いたラット血漿中のギンセノシドrg2 [j]。^ a b c d e f g h i(2006)、1- 3頁。
[13] 黄 Y、柳 J Hにする。薬物動態 研究 ギンセノシド20 (s) - rg3の hplc-elsdによるラット実験[j]。^ a b c d e f g h i j j pr med theory,2005,12(9): 2564-2566。
[14] cai z, qian t, wong r,et al.液体クロマトグラフィー-elec-代謝と製薬のためのトロススプレーイオン化質量分析- ginsenoside rg3の共動研究[j]。2003年アナルChim Acta 492(以上1分け1敗):283-293。
【15位】 劉l,黄j,胡x,ら。ginsenosideの同時決定 (g−re、g−rg1、g−rg2、g−f1、g−rh1) そして、ボランティアにおけるg-reの薬物動態研究におけるlc-ms / msによるヒト血漿および尿中のプロト-パナサトリオールおよびそのap-増殖[j]。 j chromatography b,2011,22(15): 2011-2017。
[16] joo k, lee h j, jeon h y,et al. ginsenoside reの薬物動態研究 with 純粋な ginsenoside Re and ginseng ベリー 抽出で マウス 使用 ウルトラ 液体クロマトグラフィー/ performance liquid chromatography 質量分析法[j]。2010年J Pharmaceut出来る、51 局番号は278-283。
〔17〕 ^ a b c d e f g h、c d e f g h。高性能液体クロマ-タンデム質量分析法を用いたトグラフィー-ラット上でのギンセノシドrb1のボリック研究[j]。2006年肛門直し、352(1):87-96。
[18] ^ a b c d e f g h j j j j j j j j j j j j j j j j j j j高麗人参由来の抗がん剤であるギンセノシドrh2のラットとイヌにおける薬物動態解析[j]。food chem toxicol,2009,47(9): 2257-2268。
[19] ヤンl,トウy,徐s,ら。in vivo薬物動態と ginsenoside rd [j]の代謝研究。^ a b c d e f g h i j chromatography b, 2007,854(1-2):77-84。
[20] wang w, wang g j, xie h t,et .液体クロマトグラフィー-質量spec- trometryによるイヌ血漿中のジン- senoside rdの測定 after solid-phase 抽出 and its アプリケーション in 犬 薬物動態研究か[J]。2007年JクロマトグラフB 852 (1-2): 8-14。
[21] 江j,李s,ゴングp l,他。ヒトにおける単回投与後shengmaiyin経口溶液の薬物動態[j]。Acta医学 大学Sci Technol ^高橋、2007年(平成19年)2月27日。
。[22] lin l, zu f y, zhang w w,et。ginsenoside saponinsのin vitro吸収に対する化合物適合性の影響[j]。あご ^ a b c d e f g h i『人事興信録』第4版、2010年、151 - 152頁。
[23] luo d f, ye j t, zhangy s,et al 体外 and absorption in rat in vivo of ginsenoside Rd固体 脂質 ナノ粒子か[J]ますあごPharmacolブル09年には25(7):923-926。
[24]大人 姑Y、王 g j,日j g,ら。ギンセノシドの薬物動態研究20(r) - rh2 ビーグル犬でlc-esi-ms [j]。2006年あごJ Clin Pharmacol人数、11(3):159-163。
[25] 頳 Y h,曽x,鳳y,ら。薬物動態と 中国の健康ボランティアにおけるginsenoside- rd injec- tionの単回投与点滴静脈内投与の耐性[j]。2009年あごJ Clin Pharmacol、25(2):116-120。
[26] peng y, wang s j, pan w s,et。ラットにおけるギンセノシドreの薬物動態[j]。j shenyang pharm univ .,2006,23(4): 197-200。
【27】 ren h c, sun j g, wang g j,et 20 (s) -プロトパナキサジオールです in rat プラズマ 使用 HPLC-APCI-MS: ラットにおける薬物動態研究の適用[j]。^ a b c d e f g h i j pharm bi - omed,2008,48(5): 1476-1480。
[28] 周w, shi r b, sun j n,et。さまざまなラットモデルにおけるqingnaoxuanqiao式のeffecの薬物動態-有効画分 [J]。j北京ユニットtradit chin med, 2008,31(4): 265-268。
[29] li x y, hao h p, wang g j,et al。パナックス全体に含まれる複数の有効成分の統合pharmacokinet- ic研究 notoginsenosides [J]。chin j . nat med,2008, 6(5): 377-381。
[30] 宋m、張s、徐xらが同時判定 3つのpanax noto参サポニンのlc-ms /によるサブナノグラムで 化合物danshenタブの薬物動態のための犬の血漿中ms - [j]。2010年JクロマトグラフB、878(32):3331-3337。
[31] 王 Z MA X,陳 X, et アル。現在 方法 and ad- vancesin微生物代謝ics[j]。2010年陳お父さん、第22(1):163-172に。


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本