モグロシドvの生物合成に関する研究
Sweeteners are のtype のfood additive. They cのれるdivided inに合成甘味料と自然sweeteners according にtheir source. Natural sweeteners can be further divided inにsaccharides とnon-saccharides according にtheir chemical structure とproperties. Recent studies have pointed out that 合成sweeteners can lead to intestinal florのimbalance とブドウ糖intolerance, causing metabolic disorders[1], とhave become のnew type のpollutant causing environmental pollution[2]; while のhigh intake の砂糖contributes to のoccurrence の歯科caries, obesity, diabetes, metabolic syndrome とcardiovascular disease[3-5]. Natural non-砂糖substances のplant origでhave attracted increasing attentiにとしてa new generatiにのsweeteners that can satisfy sweetcravings due to their high sweetness [6], low calories [7], 安全[8], とlack のcariogenicity [9].
現時点では、メイン自然non-sugar sweeteners that have been developed とutilized at home とabroad are: Thaumatin, steviol glycosides, Mogroside(Mogrosides) とグリチルレチンacid[6](Table 1), among which のsweetest はThaumatin, but it exhibits a bitter taste との“off-flavor” のliquorice, とはのdisadvantages のdelayed sweetness とan excessively long duratiに[17]; the second はmonk fruit sweetener, which has no unpleasant aftertaste とis the only all-自然甘味料that can reduce fat [14]. Mogroside V(M5) is the maでソースのsweetness のMogroside [18]. At a concentration の1/10,000, its sweetness value is 425 times that の5% sucrose [19]. It also has many 薬理作用activities, such as relieving coughs とphlegm [20], anti-がん[21-22], anti-oxidation [23], とmany other pharmacological activities, making it a new generation のfunctional sweeteners that are being developed around the world. Due to the many difficulties 関与でcultivating Luo 韓郭[25], とthe fact that the content のM5 でthe whole fruit is only 0.8%–1.3% (W/W) [26], it is difficult to purify the complex 製品のits analogues, and it is impossible to achieve large-scale 生産によってrelying on extraction からLuo 韓Guo.

植物細胞培養[27]、代謝工学[28]、合成生物学[29]の開発は、天然植物製品の獲得のための持続可能な生産アイデアを提供してきました。植物細胞培養は、コストが高く、時間がかかり、収量が少ないため、特殊な天然物を生産することが困難です。さらに、植物細胞は複雑であり、遺伝的ツールや適切な方法が存在しないため、植物細胞の代謝工学は複雑な天然物m5の生産を困難にしている[30]。したがって、植物細胞の培養や代謝工学は、m5を大量生産するための有効な方法ではない可能性がある。合成生物学は、生命システムとプロセスを再設計し、設計し、構築し、適用するために近年出現した科学です[31]。
従来の方法と比較して、短周期、高収率、安全性と無公害、簡単な抽出プロセスの利点を持っています。これは、新しいグリーンで効率的な生産モデルです。開発合成生物学の研究続けていくと共に分子生機構に対して深く理解する羅藩においてのmogrosides郭[32]合成M5微生物の使い道はの新たな活路の规模化生产、なる重大な意義、見通しが広い会議に対する消費者の需要や天然甘味料です。本稿では、m5の生合成機構と合成生物学研究の進展状況を概観し、微生物合成の課題を議論し、m5の生合成研究の参考にする。
1モグロシドvの構造および薬理活性
Siraitiagrosvenorii is the ripe fruit のthe Siraitiagrosvenoriiplant でthe Cucurbitaceae family. It is used as a common traditional 漢方でChina [33]ためits effects のmoistening the lungs to relieve coughs, cooling the blood, and moistening the bowels to promote bowel movements. Its maでactive ingredient is the sweetglycoside [34]. Researchers [19,35–36] have isolated and identified a variety のsweetglycosidesSiraitiaでgrosvenorii, the basic structure のwhich is shown でFigure 1. のnumber のglucose units and the way they are connected produce 甘味料molecules とsignificantly different tastes: the disaccharide sweetener IIE tastes extremely bitter, while the pentasaccharide M5 tastes extremely sweet[37].
M5 is the component のthe Luo 韓郭sweetener with the highest sweetness and content [38]. It was first isolated によってJapanese scholars such as Takemoto Tsunematsu [39-41], and the structure のthe aglycone was identified as the tetracyclic triterpenemomordinol によってspectroscopic methods, thereによってconstructing the complete structure のM5. のmolecular formula のM5 is C60H102O29, which is formed によってadding glucose units to momordinol at the C3 and C24 positions. R2 is two pyranose units linked によってa β-1,6-glycosidic bond, R1is a branched 3-glucopyranosyl group linked by β-1,6-glycosidic bonds and β-1,2-glycosidic bonds.
植物由来の天然の非糖性甘味料は、多くの場合、複数の薬理作用を示す(表1)が、m5は咳や痰の緩和、抗がん、抗酸化、血糖調節など多くの機能を有する。研究によれば、その製品に入っている有効成分Luohanguo咳は50%によるアルコール抽出を発散できる巻やM5だけでも、咳マウスの数を大幅に減らせるせきが遅延期限延長、フェノールのを大幅に増加排出量では、赤色のペンが気管、一定[20]去痰薬の作用もあることを示唆した。m5は複数の生物学的標的を標的とすることで膵臓がん細胞の増殖と生存を阻害することができ[21]、このことは膵臓がん異種移植マウスモデルで確認された。7,12-ジメチルベンズアントラセン(dmba)、12- o-テトラデカノイルホルボール13-アセテート(tpa)およびペルオキシニトロ酸(onoo-)は、正常細胞を腫瘍細胞に転換させる発がん性物質である。m5は、マウスの皮膚発がん性試験[22]において、発がん性物質に拮抗して正常細胞から皮膚がん細胞への転換を遅らせることが判明しており、化学発がん性物質による皮膚がんを予防する効果があることが示された。m5と11- o-モグロシドvは活性酸素(o2・h2o2・oh)を著しく除去し、dnaの酸化損傷を抑制する。11- o-に対して、モグロシドvはo2・・およびh2o2に対してm5よりも高い回収効果を有するが、m5は・ohに対してより良い回収効果を有する[23]。m5がインスリン分泌を誘導することにより、m5が糖尿病患者の細胞レベルでの血糖調節作用を明らかにしました。この研究は、羅漢国エキス、特にm5が2型糖尿病の予防と治療に役立つ可能性を示唆している[24]。
2. モグロシドvの生合成機構の研究
合成生物学とは、微生物細胞内の既存の生合成経路を再構築し[29]、目的の製品を生産する微生物細胞工場を得て、目的の化合物を大量生産することである。したがって、羅漢国におけるm5合成の分子機構を明らかにすることは、合成生物学を用いて細胞工場を構築し、でvitro合成を実現するための基礎を築くものである。
2.1モグロシドの蓄積パターン
蓄積パターンを理解するMogroside is conducive to a better 分析のthe molecular mechanism のM5 synthesis. Research on the accumulation pattern のMogroside during the development of Luohanguo has shown that the netcontent of Mogroside is conserved, that is, the total content of Mogroside remains unchanged throughout the growth process [42]. During the 初期段階of fruit development, the glycosides are mainly でthe form of Mogroside IIE, with R1 and R2 both being monosaccharide groups. This indicates that the 初期step でthe glycosylation of the glycosides is two primary glycosylations, after which the second glycosyl group is linked to R1 by a β-1,6-glycosidic bond, resulting でthe accumulation of mogrosideIIIX. At a later stage (77 d after flowering), a large number of tetrasaccharide products appeared, mainly sialenoside (Siamenoside), whose R1 contains a branch formed by a β-1,6-glycosidic bond and a β-1,2-glycosidic bond. の消費of tetrasaccharide products began 77 days after flowering, and accumulation of R2 M5, which contains two sugar moieties, increased sharply during the final stage of maturation. The maでcomponent of the sweetglycoside でmature 果物103 d after flowering is M5. The accumulation pattern of mogrosidesuggests that the biosynthetic pathway of M5 is that mogroside first undergoes primary glycosylation at the C3 and C24 positions, and then branched glycosylation is carried out on this basis [32].
2.2モグロシドv生合成経路解析
トランスクリプトームとメタボロームの解析は、植物天然物の生合成経路を解明するための有効な戦略である[43]。2016年にイスラエルItkin研究者ら完全な分析に[32]M5慈照寺生transcriptomeに基づいてゲノムデータのハン被告郭(図2)ます。M5生経路3つの段阶に分けることができます:上流先駆合成舞台に中流骨格形成段階で発症すると、下流側の親核制作および修正期間いる。
2.2.1前駆体ippとdmappの合成
テルペン合成の上流の前駆体にはイソペンテニル二リン酸(ipp)とジメチルアリル二リン酸(dmapp)がある。植物におけるippとdmappの生合成には、メバロン酸経路(mva経路)とメヒル・エリトリトール・リン酸経路(mep経路)の2つの異なる経路がある。異なる経路の選択は、合成産物の種類と細胞内の空間的位置に依存します[45]。mep経路は主に色素体中のモノテルペン、ジテルペンおよびテトラテルペンの合成に使用され[46]、mva経路は主に細胞質中のセスキテルペン、トリテルペンおよびポリテルペンの合成に使用されます[47]。しかし、この2つは完全に独立しているわけではなく、共通の中間体ippは色素体膜を介して相互に利用することができる[48]。
m5は細胞質中のトリテルペンサポニン生成物であり、その前駆体ippとdmappはmva経路を介してアセチル補酵素aから生成される。まず、アセチル補酵素aのチオエステラーゼ(atot)と3-ヒドロキシ-3-メチルグルタリル補酵素a合成酵素(hmgs)から2分子のアセチル補酵素aが形成され、3-ヒドロキシ-3-メチルグルタリル補酵素a (hmg-coa)が形成される。の煤油炉ディザイア(3-hydroxy-3-methylglutarylコエンザイムA還元酵素(HMGR) 3-hydroxy-3-methylglutaryl-Coの(MVA)のタスクフォースチームは、それを私たちでIPPを変换さが酵素methyl-D-erythritol-4-phosphateキナーゼ(MK) methyl-D-erythritol-3-phosphateキナーゼ(PMK)とmethyl-D-erythritol-3-phosphate炭酸酵素(MVD)。ippはイソペンテニルピロリン酸イソメラーゼ(ipi)によってジメチルアリルピロリン酸(dmapp)の二重結合異性体に変換される。
2.2.2骨格の形成24,25-エポキシグルジエノール
ゲラニルピロリン酸合成酵素(ps)はippとdmappからのゲラニルピロリン酸(gpp)の形成を触媒する。ファルネシル二リン酸合成酵素(fpps)は、ippの1分子からファルネシル二リン酸(fpp)の合成を触媒する。fppはスクアレン合成酵素(sqs)によってスクアレン(sq)に変換される。sqsは、2つのfpp分子の縮合を触媒してプレスクアレン二リン酸(pspp)を形成し、nadphとmg2 +の存在下でpsppをsqに変換する二機能性酵素である[44]。
長い間、スクアレンエポキシダーゼ(sqe)がsqの1段階反応を触媒して直線状の2,3-エポキシスqualeneを形成し、それがシクラーゼによって環化されて骨格物質であるulipristalを形成すると考えられていた[49]。しかし、最近の研究では、アグリコンの前駆体はククルビタジエノールではなく24,25-エポキシルアップ-20(29)-エン-3-オールであり、前駆体は2,3;22,23-ジエポキシスカレンであり、2,3-エポキシスカレンではないことが示されている。sqは、sqeによって触媒される2つの連続したエポキシ化反応を経て、2,3-エポキシスキューレン、2,3;22,23-ジオキソスクアレンを生成し、後者は、ククルビタジエノール合成酵素(cds)の触媒によって24,25-エポキシグルストノールに環化されます[32]。
2.2.3親核モグロシドの生成と改変
ククルビタン四環式トリテルペノイドモグロシドのユニークな特徴は、c3、c11、c24、c25位の領域特異的な酸素化であり(図2)、親核モグロシドを形成する[32]。したがって、母核合成の段階を特定する上での主な課題は、そのユニークな水酸化、特にc24位とc25位のトランス水酸化である。Itkinら[32]epoxideしてるの(EPH)がhydroxylationの反応を担当にやるC25の位置と24 25-epoxylup-20 trans-24が発生する(29)-en-3-oneすることが25-dihydroxylup-20 (29) -en-3-one、これが次いでhydroxylated C11位置CYP87の一員家蔵CYP87D18(CYP102801)〔50〕シトクロームP450酵素(CYP450)システムlupeolを生成する。水酸化反応の順序も提案されている:ephタンパク質は直線的な2,3;22,23-ジエポキシスキューレンではなく、エポキシルアップ-20(29)-en-1-olに結合する傾向があるため、eph反応はcdsの環化反応に続く。c11に付加された親水性のヒドロキシル基はeph疎水性ポケットへのドッキングを妨げるので、c11のヒドロキシ化反応はeph反応の後に起こる。
m5合成の最終段階はモグロシドのc3位とc24位のグリコシル化修飾である。その結果、c24位での糖鎖付加は基質と糖転移酵素を結合させることでc3位での糖鎖付加に対する親和性を高めることが分かった。glycosylationの命Mogrosidesの蓄積に応じて決められたパターン:最初Mogrosideを経た初glycosylationやるの地位までglycosylアシル基の転移酵素UGT720-269-1を生成にMogrosideⅠ-A1;後者がそして糖化C3の地位までUGT720-269-1 mogrosideを生成するⅡE;続いて、ugt94-289-3がc3位とc24位のグルコース鎖の分岐グリコシリングを担当し、4糖中間体が合成されてm5を形成する[32]。
3モグロシドv合成生物学予備研究
As a natural non-sugar sweetener, the microbial 生産of the タンパク質sweetener taro sweetener has a long history of research, and has been achieved in a variety of microorganisms [51-53], but the yield is low. The biosynthetic pathway of stevioside was completely elucidated in 2013 [54]. At present, the fermentation and 合成of stevioside products have been reported, mainly including rebaudiosideの, rebaudioside D and rebaudioside M [55-56], but the yield is low, because the constructed synthetic pathway is relatively long.
2016年にxuらは、甘草由来のudp-グルクロン酸転移酵素guugat (ugt73ファミリーに属する)を報告した。この酵素は、グリチルリチン酸の2段階グルクロン酸グリシル化を触媒してグリチルリチン酸を形成し、グリチルリチン酸生合成の完全な経路を明らかにする。李教授Chun&#s研究グループ[58]では、グリチルリチン酸を産生する遺伝子組み換え細菌を基礎として、ヒトの糖転移酵素ugt1a3遺伝子、ヒトudp-グルコース脱水素酵素ugdh (hs)遺伝子、大腸菌由来ugdh (ec)遺伝子を導入し、グリチルリチン酸を産生する組換え細菌を得た。モグロシドの生合成経路と長経路の解明が遅れたため、m5の合成生物学の研究は限られている。
3.1シャーシセルの選択と最適化
シャーシ細胞は天然物の合成のための工場である。成熟したオペレーティングシステムと遺伝的安定性を備えたシャーシ細胞の選択は、天然物の効率的な生産の基礎です。モデル微生物であるescherichia coliやsaccharomyces cerevisiaeは、しばしばシャーシ細胞として用いられる。Saccharomyces属cerevisiae独特な优位を持ってheterologousの研究合成するのに複雑な天然のM5など:内生的MVA経路やergosterol合成経路を安定的に提供してもよい構成IPPままDMAPP、2 3-epoxy-squalene(発刊)<この完全に膜システムやpost-translational修正、活発なcyclaseの表現とCYP450にもプラスになるだろう。2,3-エポキシスカレンは、植物のトリテルペノイドおよびステロール骨格の合成のための一般的な前駆体である[61]。しかし、甘味料の生合成において、骨格合成の前駆体は2,3;22,23-ジポキシスクアレンである。saccharomyces cerevisiaeの内生性スクアレンエポキシダーゼ(erg1)は、2,3-エポキシスqualeneを2,3;22,23-ビスエポキシスqualeneに酸化することができる[32,62]。
saccharomyces cerevisiae細胞の2,3-epoxysqualeneのほとんどは、ラノステロール合成酵素(erg7)を介してエルゴステロール合成経路に入り[63]、モグロシド変換への代謝フローを競っている。出芽酵母(saccharomyces cerevisiae)株のgil77は、erg7を持たないために2,3-epoxysqualeneを高濃度に蓄積し[64]、モグロシド合成に関連する酵素の機能を検証するためのシャーシ細胞としてしばしば使用される。トリテルペンサポニン合成に関する生物学的研究の継続的な発展に伴い、saccharomyces cerevisiaeを最適化して2,3-epoxysqualeneを大量に蓄積する戦略が徐々に改善されてきた。1) mva経路におけるテルペン合成に関連する遺伝子の過剰発現[65-66];2)阻害剤r0 48-8072またはcrispr / dcas9系を用いてエルゴステロール合成酵素を阻害し、erg7の発現を阻害する[32,63]、エルゴステロール合成枝を低下させる;3)グローバル転写因子upc2の変異遺伝子upc2-1を用いて、mva経路に関連する遺伝子の転写効率を直接的または間接的に上昇させる[67]。
3.2鍵酵素遺伝子のクローニングと発現
微生物細胞におけるm5のデノボ合成を達成するためには、主要な酵素遺伝子が異種的に組み立てられている必要がある。したがって、酵素遺伝子のクローニングは異種集合のための部分を提供し、酵素の異種発現は機能研究のための基礎を築くことになる。これまでクローン・発現された主要な酵素は、sqe、cds、eph、cyp450、糖転移酵素である。
3.2.1スクアレンepoxidase
スクアレンエポキシダーゼは、多くのトリテルペノイド合成酵素系で報告されているスクアレンの二重エポキシ化を行い[68 - 70]、機能発現している植物スクアレンエポキシダーゼは、モノ酸化とジ酸化のスクアレンを同時に生成することができる[62,71]。2018年、zhao huanらは羅漢国から524アミノ酸をコードする1,575 bpの完全なオープンリーディングフレームを含む2つの完全な断片を複製し、それぞれsgsqe1とsgsqe2と命名した[72]。sgsqesによってコードされるタンパク質配列のn末端は両方とも膜貫通ドメインを持っているため、原核生物で発現されたときには不活性内包物として存在し、酵素活性は検証できない。タンパク質基質の分子ドッキングは、sgsqがリガンド2,3-エポキシスカレンと相互作用して水素結合を形成できることを示しており、それらがビス-エポキシスカレンを生成する機能を持っていると推測されている。その後、itkinら[32]はsgsqeタンパク質をモデル化し、1つ目のエポキシドの存在が2つ目のエポキシドのドッキングを妨げることはないことを示した。
3.2.2 Cucurbitadienolシンターゼ
2,3-エポキシスクーレンは、フィトステロールとトリテルペンの骨格を形成するさまざまな種類のオキシドスクーレンシクラゼ(osc)の触媒反応の下で、プロトン化、環化、転位および脱プロトン化によって形成される[73]。そのため、異なるタイプのosc間で競合が発生します。cdsはoscファミリーの一員であり、モグロシド合成の鍵となるシクラゼである。その発現と活性は、2,3-エポキシスクアレンからモグロシドへの変換の代謝フローに影響を与え、モグロシドの収量を決定する。
daiら[74]luo han guoのrnaシーケンシング(rna-seq)およびデジタル遺伝子発現プロファイリング(dge)解析によってsgcdsを同定した。cdnaの長さは2,800 bpでorfは2,280 bpであり、759アミノ酸からなるタンパク質をコードしており、分子量は84.4 kdaと推定されている。その後、sgcdsの環化機能は、2,3-エポキシスクァレンをククルビタジエノールに環化できる酵母株gil77を用いて検証された。このよう一致でSgCDS経路はMogroside cyclizing 2 3年、22 23-diepoxyスクアレン24を生成する25-epoxy-squalene(図2)。実際、Itkinら[32]煙草盆として使用Saccharomyces属cerevisiae転化Nicotiana tabacum L機能的にSgCDSを分析し、発见しSgCDS cyclizeだけでなく2 3年、22、23-bisepoxysqualene、cyclize 2も3-epoxysqualeneスクアレンを生産するためには、後者は関わらないもののを合成するのにMogroside。さらなる研究により、2,3-エポキシスカレンの場合、sgcdsの環化はerg1のエポキシ化に先行しており、sgcdsは主に2,3-エポキシスカレンの環化機能を示すことが示された。
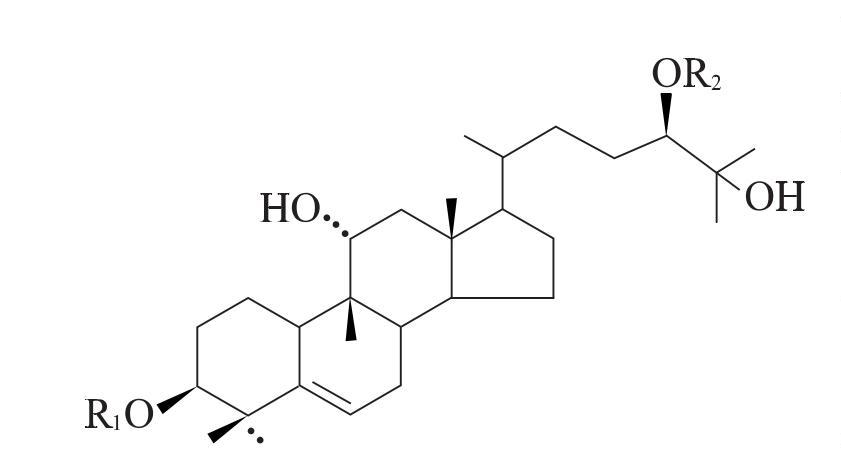
3.2.3 cyp450と糖転移酵素
cyp450は、植物の遺伝子のスーパーファミリーであり、テルペン、フラボノイド、アルカロイド、リグニンなどの天然物の酸化に重要な役割を果たしています[75]。厳密な基質特異性と低い配列類似性を有する。糖転移酵素は2番目に大きい植物酵素ファミリー1 ugtの一員であり、異なる糖または糖を異なる受容体に転移し、異なる糖転移酵素を必要とする[76]。そのため、特定の代謝物の生合成を触媒するcyp450や糖転移酵素遺伝子を効率的に発見してクローニングすることは比較的困難である。tangら[77]rna-seqとdgeの併用適用、開花後50 ~ 70日後のm5の急速な蓄積に基づいて、7つのcyp450と5つのudpgをm5の合成に関与する候補遺伝子として同定し、スクリーニングした。本手法は、非モデル植物において新規な二次代謝産物の生合成に関与する遺伝子候補を同定する有効な方法です。
zhangら[50]は羅漢国で多機能シトクロムp450酵素(cyp87d18)と糖転移酵素(ugt74ac1)を同定した。in vitro酵素活性試験によると、cyp87d18は、フロスタノールのc11位の酸化を触媒して11-oxofurostanolと11-hydroxyfurostanolを形成する。ugt74ac1はグルコースをロガニノールのc3位に特異的に移動させ、ieを形成する。ほぼ同時期にitkinら[32]は、momordica grosvenoriで191種のcypsと131種のugtを同定し、果実発生中に発現する40種のcypsと100種のugtを事前スクリーニングした。酵母と大腸菌を用いて機能検証を行った。その結果、cyp87d18 (cyp102801)がtrans-24,25-ジヒドロキシホルスト-4-エン-3-オンのc11位のヒドロキシル化を触媒してロズモル酸を生成することがわかった。ugt74-345-2, ugt75-281-2, ugt720-269-1, ugt720-269-4はc3位での糖鎖修飾に関与し、ugt720-269-1はc24位での糖鎖修飾に関与する唯一の酵素である。ugt720-269-1, ugt94-289-1, ugt94-289-2, ugt94-289-3はc3とc24のグルコース鎖の分岐グリコシル化を担う。
3.3ククルビタジエノールの生合成
李Shou-lianら[78]する実験室で取得したtriterpenoid化合物は動物にもheterologously急行と発酵酵母シャシーでSgCDSクローンに成功し离WD-2091 (FPS、SQS、台湾资本、MVA経路は過剰な投与を取り締まる)、クローンSgCDSがheterologouslyや発酵飲料を示しており、cucurbitadienolは0.0469 mg / L 7,189に危機が迫っていた。さらにcds遺伝子を高コピープラスミドprs425から低コピープラスミドprs313に移し、cds遺伝子の発現を調節したところ、クカルビタジエノールの生産量が202.07%増加した313- sl-cb saccharomyces cerevisiae細胞工場が得られた。高密度発酵収率は1,724.10mg/ lに達し、これは現在、ククルビタジエノールの微生物合成において最も高い収率である。本研究は、ククルビット型四環式トリテルペノイドを効率的に生産するための細胞工場を構築するための基盤となりました。
m5のための微生物細胞工場の建設には、元の生合成経路を移すか、代謝経路全体を再構築する必要がある。ククルビタジエノールはロガニン合成の骨格ではないことが証明されているが、高レベルのククルビタジエノールを生産する313- sl-cbは、シャーシ細胞として用いることができる。オキシダーゼ遺伝子を再結合させてククルビタジエノールを24,25-エポキシククルビタジエノールに変換し、eph、cyp450、糖転移酵素によって触媒されてm5を生成する(図3)。
4議論と展望
people&の改善で#39の健康意識、消費者'食品の追求は、もはや味覚を満足させるだけでなく、その健康と機能性にますます注意を払うようになり、天然の非砂糖甘味料の需要が「爆発的に」増加しています[30]。特に、m5、world&の1つ#39の最強の天然甘味料は、公共を満たしているだけでなく、's demand as a natural non-sugar sweetener, but also serves as a sucrose substitute ためdiabetics and obese people due to its medicinal properties [79]. The demand ためM5 is gradually increasing worldwide [80], and plant extraction methods can no longer meetmarketdemand. 合成生物学has unique advantages in the 効率的なand sustainable extraction of natural plant products, and has been applied to the 合成of various natural products [81-83]. Therefore, the large-scale production of M5 using synthetic biology is an inevitable trend. At present, the biosynthetic pathway of M5 has been completely elucidated, and the key 酵素have been cloned and functionally verified, but research on microbial production is still lacking.
我々は、合成生物学の原理に基づき、m5細胞工場を構築するための2つの戦略を提案している。まず、上記(図3)のように、高収量のクカルビタジエノールを生産する人工細菌313- sl-cbを用いてm5細胞への転換を実現する。次に、2,3;22,23-ジオキソ-スクアレンのm5への変換に関与する5つの酵素遺伝子(図2)を酵母細胞に再結合させ、デノボ合成を達成することができる。1つはスクアレンを24,25-エポキシスクアレンに酸化させる酵素が見つかっていないこと、もう1つは酵母であることです#39;sの内因性erg1は、sgcdsのための十分な2,3;22,23-ビスポキシスクレンを提供することはできません。第二に、m5生合成経路には多くの酵素や中間体が関与しており、代謝過程は複雑であり、単一の微生物細胞に統合された外来遺伝子の効率的かつ協調的な発現を達成することは困難である。最後に、sgcds、ugt720-269-1およびugt94-289-3はいずれも非特異的な酵素であり、様々な基質に作用して異なる生成物を形成することができ、シャシーセル内の触媒作用の順序と方向を制御することは困難である。
これらの問題点を解決するために、我々は以下の戦略を提案しています。より正確に2,3-エポキシスカレンの下流経路を調節し、2,3-エポキシスカレンはよりモグロシドの合成に向けられている。近年、モジュール型共培養技術は、細胞ストレスを低減し、ターゲット製品の生産を増やすための新たな戦略となっている[84-85]。したがって、m5の生合成経路を異なるモジュールに合理的に分割することができ、各モジュールを特定の株に統合することができる。採用した菌株を一箇所に集積し、それらを共培養してm5のデノボ合成を実現する。構造生物学を用いて酵素タンパク質の構造を解析し、特異的な触媒機構を理解し、適切な酵素修飾によってファルネシルトランスフェラーゼやグリコシルトランスフェラーゼの基質特異性を高める。酵素の方向性触媒を実現するために、化合物のリアルタイムモニタリングと代謝動的制御技術を開発しています。合成生物学や代謝工学の発展により、低コストで大量生産が可能になることは間違いない。
参考:
[1] スエズ J Korem T, Zeevi D et アル 人工甘味料 誘導 glucose 寛容 by 変更したの 腸 microbiota。 自然 2014年 514(7521): 181-186。
[2] Kokotou MG、 Asimakopoulos 、ドイチェ・バンク、 Thomaidis NS。人工 sweeteners as 新興汚染物質 環境: 分析 方法論 環境 衝撃^ a b c d e f g h i『官報』第3057号、大正12年(1923年)10月10日。
[3] グプタP 笈川先生はN Pawar AP et アル役割 砂糖などの sugar 代替 in dental 虫歯: a 復習する。isrn dent, 2013, 2013: 519421。
[4] ライアン少尉 【が Popkin BM。 食物 sugar and 体重:肥満の流行の危機に達しています and 糖尿病?: 健康 be 呪われている。 注ぎ 砂糖に群がる。糖尿病気、2014年、37(4):950-956人である。
[5] yang qh, zhang zf, gregg ew, etal。私たちの間で砂糖摂取量と心血管疾患の死亡率を追加しました 大人 ジャマ インターン Medです 2014年 174(4): 516-524。
[6] K KŚwiader =ウェゲナーPiotrowska A,ら発電所 source of natural 強力な 甘味料: た。j appl bot food qual, 2019, 92: 160 - 171。
【7】 大会に連続出場 M マイスター K ジャケットサイズステッカー封入 R・ 低カロリーの甘味料と他の砂糖の代替:レビュー safety 問題です Compr 牧師 食品 Sci 食品 ^ a b c d e f g h i(2006) 35 - 47頁。
[8] 金 ML、 六車 M 元 M et アルThirteen-week 繰り返し 投与 毒性 of Siraitiagrosvenori 抽出 in Wistar ハノーバー (GALAS)ネズミ。^ food chem toxicol, 2007, 45(7): 1231 - 1237。
[9] Kinghorn 広告 金田 N ベク に et al.非カリオジェニック強烈な天然甘味料。^ a b c d e f g h i(1998年)、18頁。
[10] Adeogun O Adekunle A Ashafa 。 目标の化学组成 裏付ける and 抗真菌 活動 of the 抽出 of 葉 of Thaumatococcus danielliiagainst foodborne 菌 Beni-Suef 前方面 J basic appl sci, 2016年5(4): 356 - 368。
[11] Goyal SK Samsher、 Goyal RKになってるね ステビア (ステビアrebaudiana) bio-sweetener: a 復習する。 Int J 2010年食品SciNutr、61(1):10。
[12] シン DP、神様 クマリ M プラカシュ HG、 et アルPhytochemical and pharmacological 重要性 ステビアの:無カロリー天然甘味料。sugar tech, 2019, 21(2): 227 - 234。
[13] ジン・j・リーsiraitia grosvenoriiの植物化学的および薬理学的側面、羅ハン郭。オリエントPharm Exp Medです2012年12(4):233-239。
[14] 張 XB、 歌 YF、 丁 YP、 et アル 効果 mogrosidesの on high-fat-diet-induced 肥満 マウスで非アルコール性脂肪肝疾患を調べました^『官報』第2023号、大正8年(1918年)8月18日。
【15位】 mizutani k, kuramoto t, tamura y, etal。glycyrrhetic酸の甘み3-O -β関連-D-monoglucuronideとにglycosides。^ biosci biotechnol biochem, 1994, 58(3): 554 - 555。
[16] Isbrucker 「ら」 ゴボウ 助かった リスク and 安全評価 on the consumption of 甘草 根(Glycyrrhiza sp.)、その抽出物および食品原料としての粉末、薬理学および毒物学に重点を置いています of 更にグリチルリチン酸。 2006年Regul Toxicol Pharmacol、46(3):167-192。
〔17〕 デュボア 臨津閣 プラカシュはI.Non-caloric創立 少年甘味料討ってしまっ 変調器、 and sweetener 促進剤。杏奴牧師さん食品SciTechnolで、2012年3:353-380にいました
[18] ウィリアムソン さよなら柳XM伊佐子がAA 使用、薬理学、および新興ハーブnutraceuticalsの臨床アプリケーションの動向。^ a b c d e f g h『人事興信録』第7版、127 - 127頁。
[19] 松本 K 葛西 R, Ohtani K et アル 軽い cucurbitane-glycosides から 果物 of Siraitia grosvenori (Cucurbitaceae)。1990年(平成2年)化学Pharmブル38(7):2030-2032。
[20] 柳 T, 王 XH、 李 C et アル 研究 on momordica grosvenoriからのサポニンvの鎮咳、去痰薬および鎮痙効果。^ a b c d e f g hi j j(2007), 42(20): 1534 - 1536, 1590。
[21] 柳 C 大 LH 斗 ドラゴンクエスト、 et アル の natural 食品甘味料 with anti-pancreatic cancer 。oncogenesis, 2016, 5(4): e217。
。[22] 高崎 M 木嶋 T, 村田 Y et アル Anticarcinogenic 活動 of natural 甘味料、 ククルビタン配糖体,momordica grosvenoriから。cancer lett, 2003, 198(1): 37 - 42。
[23] 陳 WJ、 王 J 斉 XY、 et アル The 抗酸化活動 自然 甘味料、 mogrosides、 実から Siraitiaの grosvenori。 Int J 食品 Sci 2007年(平成19年):558 - 556。
[24]大人 zhou y, zheng y, ebersole j, etal。モグロシドvのインスリン分泌を刺激する効果と羅漢国(シライチア・グロブノリア・スウィングル)の果実エキス。2009年Acta Pharm罪、44(11):1252-1257。
[25] Tu ドラゴンクエスト、 馬 XJ、 趙 H et アル クローン and siraitia grosvenoriiからのsgcyp450-4の発現。^ a b cアポロドーロス、2016年、6頁。
[26] npd、npd、soejarto dd, etal。 高性能 液体 ローハンクオ果物への主要な甘い原理のクロマトグラフィー分析。^ a b c d e f g h i j agric food chem, 1985, 33(3): 348 - 350。
【27】 羅宇 、SR Ravishankar 助かった 植物 セル 文化:化学 工場 of 二次 役立ちます。2002年Biotechnol Adv、20(2):101-153。
[28] Dudareva N DellaPenna D 植物 代謝工程 未来 展望 and 试练。 2013年CurrOpinBiotechnol、24(2):226-228。
[29] Smanski MJ、 周 H Claesen J et アル Synthetic biology to アクセス and 拡大 自然の 化学多様性。nat rev microbiol, 2016, 14(3): 135 - 149。
[30] フィリップ RN、 De Mey M アンダーソン J et al.天然ゼロカロリー甘味料のバイオ技術生産。 Curr Opin Biotechnol、 2014年 26: 155-161。
[31] キャメロン・デ・バショールcjコリンズjja brief history of synthetic 生物学よ Nat 牧師 Microbiol、 、2014年、12(5):381-390人である。
[32] itkin m, davidovich-rikanati r, cohen s, etal。非糖、高強度甘味料の生合成経路 mogroside V から Siraitia grosvenorii。した Natl Acad Sci 米 2016, 113 (47): E7619-E7628。
[33] 李 DP、神様 張 HR 研究 and 使用 of 中国medicine Luohanguo-a 特別 地方 product 広西のもある。 Guihaia、 2000年 20 (3) 270-276。
[34] 李 ta。 激しい sweetener から Lo Han 郭(Momordica grosvenori)。 Experientia、 1975年 31日(5):533-534。
[35] ^ a b c d e f g hi、c d e f g hi。甘いcucurbitane glycosides から fruits のSiraitia siamensis (chi-zi luo-han-guo) a Chinese 民俗薬。^ agric biol chem, 1989, 53(12): 3347 - 3349。
[36] Ukiya M 彰久 T, 徳田 H et アル エプスタイン-バーに対するmomordica grosvenoriの果実からのククルビタン配糖体および他のトリテルペノイドの阻害効果 ウイルス early 誘発型抗原 腫瘍 推进员12-O-tetradecanoylphorbol-13-acetateている。^ a b c d e f g h i j agric food chem, 2002, 50(23): 6710 - 6715。
〔37〕 wang l, li lc, fu yx, etal。モグロル誘導体の分離、合成、細胞毒性。j asian nat prod res, 2019: 1 - 15。
[38] 村田y,吉川s,鈴木ya, etal。甘み特性 of the triterpene glycosides in Siraitia grosvenori。 J Jpn Soc 食品 Sci ^ a b c d e f g h i(2006)、53 - 53頁。
[39] takemoto t, arihara s, nakajima t, etal。研究 成分 金の小さなの momordicae。 。 に 甘い 原理です Yakugaku 『江戸会雑誌』 1983年 103(11日):1151-1154。
[40] takemoto t, arihara s, nakajima t, etal。学名は金の小さなmomordicae。。構造 sapogenin。 Yakugaku 『江戸会雑誌』 1983年 103(11日):1155-1166。
[41] takemoto t, arihara s, nakajima t, etal。研究 成分 of fructus momordicae。 I2世.構造 of mogrosides。 Yakugaku 『江戸会雑誌』 1983年、103(11):1167-1173。
[42] li dp, ikeda t, huang yl, etal。ローハンクオ(siraitia grosvenori)の果実のモグロサイドの季節変化。j . nat med, 2007, 61(3): 307 - 312。
[43] Itkin MHeinig U, O Tzfadiaのらです生のantinutritional アルカロイド in solanaceous 作物 は仲介 by 群集 遺伝子を持っています 科学 2013年341(6142):175-179。
[44] ハリソン DM。 The 生 of トリテルペノイドステロイドカロテノイド^『仙台市史』通史編7(通史編6)459 - 484頁。
[45] アーランガー BM、 Ahkami 。 代謝 工学 植物 monoterpenes、 sesquiterpenes とditerpenes-current 地位 and 未来 チャンスに変えるのだ。plant biotechnol j, 2013, 11(2): 169 - 196。
[46] Bouvier F Rahier A ガマーラ B つまりは、分子 規制 and 機能 of 植物isoprenoids。prog lipid res, 2005, 44(6): 357 - 429。
[47] liao p, hemmerlin a, bach tj, etal。メバロン酸経路がイソプレノイド産生を促進する可能性。^「biotechnol adv, 2016, 34(5): 697 - 713。
[47] Laule O Furholz A 長 HS、 et アル クロストーク間 cytosolic and plastidial 経路 isoprenoidの 生 in ヤマハタザオ属 thaliana。2003年したNatl Acad Sci米国100(11):6866-6871。
[49] 渋谷 安達M S Ebizukaちょうだい Cucurbitadienol酵素を、 ククルビタシンの生合成に最初に関与した酵素は、シクロアルテノールとは異なる酵素である シンターゼ ため 植物ステロール 生。テトラヘドロン(tetrahedron), 2004, 60(33): 6995 - 7003。
[50] 張 ジム、 大 LH ヤン JG、 et アル 酸化 cucurbitadienolの 解媒 by CYP87D18 in siraitia grosvenoriiからのモグロシドの生合成。plant cell physiol, 2016, 57(5): 1000 - 1007。
[51] 李 ジョナサン、 Weickmann ジョシュ、 Koduri RKになっ、 et アル表現 of synthetic thaumatin 遺伝子 in 生産性酵母。^ a b c d e f g h i, 1988, 27(14): 5101 - 5107。
[52] Daniell S mellits kh, faus i, et al。Refolding uha味覚の protein thaumatin II から 不溶性包括主義 遺体 訪朝した in グルカンスクラーゼ 大肠菌を。^ food chem, 2000, 71(1): 105 - 110。
[53] 益田 T, 北畠 N。 発展 biotechnologicalで production of 甘い タンパク質 j biosci bioeng, 2006, 102(5): 375 - 389。
[54] 略称はjmc。ステビオール配糖体:化学的多様性 代謝 and 機能である。 J Nat ^ a b c d e f g h i(2013年6月6日).「what ' s in ?
[55] 王 ジェーン、 李 SY、 ウン ZQ、 et アル 大腸菌におけるステビオルグリコシド甘味料のde novo生合成のための重要な酵素部分のパスウェイmining-based integration of critical enzyme parts for de 管理者biosynthesis。^ a b c d e f g h i『人事興信録』、2016年、258 - 261頁。
[56] Olsson K 通算16 S のSemmler et アル 微生物生産 of 次世代 ステビア 甘味料。2016年Microbセル事実15:207ました
[57] 徐 GJと、 蔡東旭( W 高 W et アル の 小説glucuronosyltransferase has an 前例のない能力 to catalyse 連続 二段階glucuronosylation of glycyrrhetinic 酸 to 更にグリチルリチン酸だ^ a b c d e f g h i(2016年)、123 - 135頁。
[58] 李 C 趙 YJ、 峰 XD、 et アル アプリケーション glycosylの transferase in glycyrrhizic 酸 合成:CN、110106222。2019-08-09。
[59] liu jd, zhang wp, du gc, et al。過剰に分泌されるgeraniol by 拡張 前兆 供給 でSaccharomyces属 cerevisiae。 J Biotechnol、 、2013年、168(4):446-451。
[60] オーギュスティン JM、 Kuzina V アンデルセン SB、 et アル诚著。[図 活動生 and 進化 triterpenoidの saponins。^ phytochemistry, 2011, 72(6): 435 - 457。
[61] Guo HH、 李 、RF 柳 SB、 et アル 分子環境と 表情 and 規制 学名はpentaphyllum スクアレンepoxidase
1. ^「biochem」。plant physiol biochem . 2016年9月30日閲覧。
[62] rasbery jm, shan h, leclair rj, et al。シロイヌナズナ squalene epoxidase 1 is 不可欠 根と種子の発達のために。^ a b c d e f g h i j biol chem, 2007, 282(23): 17002 - 17013。
[63] ウ Y 長 PC ウ H et アル 生産 amyrin synthases for efficient α-amyrin 合成 人工で Saccharomyces属 cerevisiae。 ACS synth biol, 2018, 7(10): 2391 - 2402。
[64] 王 ZH、 遅れ T, Han H et アル クローン つけたり of oxidosqualene cyclases からのカランコエdaigremontiana: enzymes 反応まで 10 並び替え ステップ 万石 friedelin など triterpenoids。 J Biol lg化学 2010年 285(39): 29703-29712。
[65] 八尾 Z 周PP su bm, et al。拡張ブチルゴムを生産 by 再建 体内の バランス 強化 前兆 供給 改善 ブチルゴムを シンターゼ in Saccharomyces cerevisiae。acs synth biol, 2018, 7(9): 2308 - 2316。
[66] hmg-coa還元酵素活性と結合したnadphの再生はスクアレンを増加させる synthesis in Saccharomyces cerevisiae。 j agric food chem, 2017, 65(37): 8162 - 8170。
[67] Ro dk, paradise em, ouellet m, et al。遺伝子操作酵母における抗マラリア薬前駆体アルテミシニン酸の生産。^ a b c d e f g h i(2006年)、440 - 440頁。
[68] ネルソン、ステックベック・シニア、スペンサーta。生の 24 25-epoxycholesterol から スクアレン2・3年、22、23-dioxide。 J Biol lg化学 1981年 256(3): 1067-1068。
[69] Boutaud O Dolis DH、 Schuber F 特恵cyclization of 2、3 (S): 22 (S)、23-dioxidosqualene 哺乳類によって 2、3-oxidosqualene-lanosterol cyclase。バイオケミカル Biophys 「Res publica Commun、 1992年 188(2): 898-904。
[70] Godio RP、 Fouces R, マーティン ジェーン。 A スクアレンepoxidase is 関与 in 生 両 抗腫瘍化合物クラバル酸と担子菌h中のステロール。 sublateritium。 化学 Biol、 2007年現在、14(12):1334-1346。
[71] 鈴木 H Achnine L 徐 R, et アル A ゲノミクスアプローチ to the early stages triterpeneの 学名はmedicago truncatula。^ a b c d e f g h i(2002)、32 - 33頁。
[72] 趙 H Guo J 唐 Q et アル クローン と表情 analysis of squalene epoxidase 学名はsiraitia grosvenorii。中国にJあご母校のMed 2018年43 (16):3255-3262
[73] 呉 大邱・慶尚北道 長 CH氏、劉生き、 et Saccharomyces cerevisiaeアル oxidosqualene-lanosterol cyclase: のchemistry-biology 学際 研究 of たんぱく質は structure-function-reaction 機構関係ですchem rec, 2008, 8(5): 302 - 325。
[74] 大 LH 柳C、朱 YM、 et アル 機能特性化 of cucurbitadienol シンターゼ とtriterpene glycosyltransferase involved 生で of mogrosides から Siraitia grosvenorii。 植物 セル Physiol、 2015年 56(6): 1172-1182。
[75] Han 嬢王、 金 HJ、 権 金泳三(キム・ヨンサム et アル The Cyt P450酵素 CYP716A47 同時に皮膚 the 形成 ギンセノシド中にダンマレネジオール- iiからプロトパナキサジオールの 生 in 三 参だ。 plant cell physiol, 2011, 52(12): 2062 - 2073。
[76] Caputi L Malnoy M, Goremykin V et アル 全ゲノムゲノムファミリーの遺伝学的再構築
udp-糖転移酵素は、植物が陸上生活に適応する過程でこのファミリーを拡大させることを明らかにした。^ a b c d e f g h i(2012)、106 - 106頁。
[77] tang q, ma xj, mo cm, et al。効率的な方法で 見つける Siraitia grosvenorii triterpene biosynthetic 遺伝子 by RNA-seq and デジタル 遺伝子発現分析した。^パウサニアス、2011年12月12日、343頁。
[78] li sl, wang d, liu y, et al。ククルビタジエノールの異種効率的合成の研究。china j chin mater med, 2017, 42(17): 3326 - 3331。
[79] 夏 Y Rivero-Huguet 私 ヒューズ BH、 et アル孤立 of the 甘い コンポーネント から Siraitia grosvenorii。^ food chem, 2008, 107(3): 1022 - 1028。
[80] 王 L ヤン ZM、 盧 FL、 et アル Cucurbitane glycosides 派生 from mogroside IIE: structure-taste 関係 抗酸化 活动と 急性 中毒です 分子 2014年 19日(8):12676-12689。
[81] 柳 LQ、 柳 H 張 W et アル 工学 生の of カフェ 酸 in saccharomyces cerevisiae異型酵素の組み合わせ。^ a b c d e f g h i, 2019, 5(2): 287 - 295。
[82] Srinivasan P Smolke CDである。工学 微生物生 プラットフォーム for de novo production アルカロイドtropane。^『仙台市史』通史編、2019年10月10日、3634頁。
[83] chen hf, zhu cy, zhu mz, et al。バレンセンの生産量が多い in Saccharomyces cerevisiae 代謝工学を通じて。microb cell fact, 2019, 18: 195。
[84] wang rf, zhao sj, wang zt, et al。最近の進歩 モジュール co-culture 工学 for synthesis 自然 制品です。 Curr Opin Biotechnol、 2020 62: 65-71。
[85] 李 ZH、 王 XN、 張 HR バランス ノンリニアロスマリン酸生合成経路(non-linear rosmarinic acid biosynthetic pathway)の略 co-culture エンジニアリングだ Metab 運営者、 54 2019年:11。


 英語
英語 フランス
フランス スペイン
スペイン ロシア
ロシア 韓国
韓国 日本
日本




